

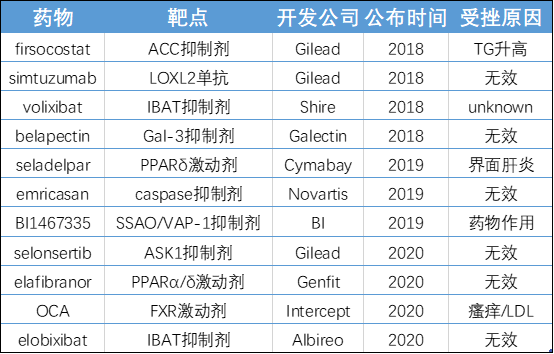
1、发病机制复杂

2、诊断困难
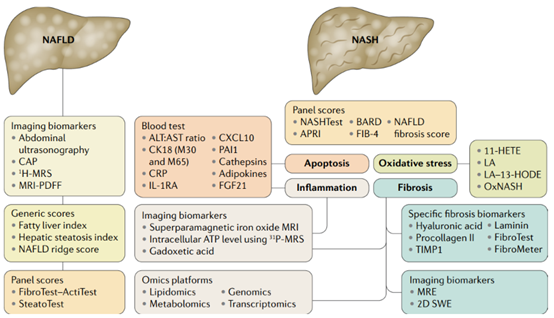
3、NASH动物模型的难点
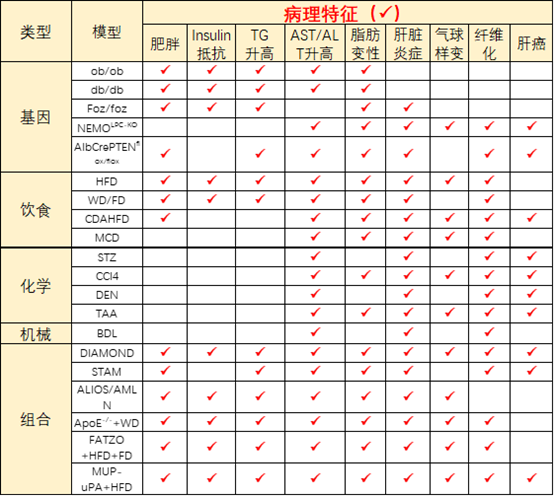
4、NASH临床试验的难点
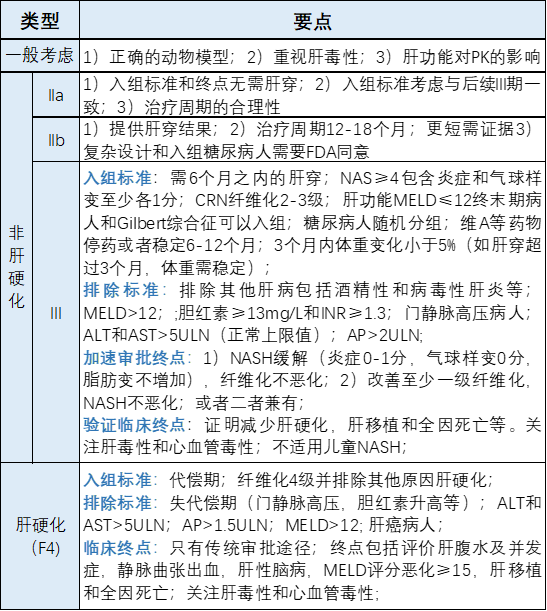

1、挫折中继续前行
2、让人期待的临床药物

3、老药新用
4、天然药物
5、新机制和新靶点
6、新型药物技术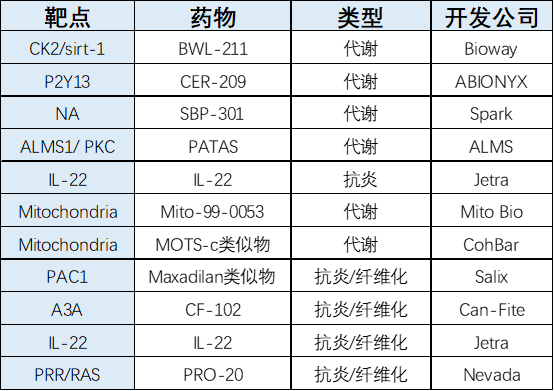
7、新的疾病定义
8月份,20多位国际权威专家联合呼吁将非酒精脂肪肝病(NAFLD)重新定义,改名为代谢紊乱相关的脂肪肝病(Metabolic dysfunction-associated fatty liver disease,MAFLD)。一个字母之差,含义发生了很大变化。新的定义更加强调代谢因素,不再区分酒精和非酒精脂肪肝(28)。确实,依据饮酒历史区分两种疾病可能过于简单化了。代谢或者肠道菌紊乱产生的内源性酒精及其代谢产物对肝脏的损伤可能也是NASH的发病机制之一。新的诊断标准如图4所示,肝脏脂肪变性的肥胖和糖尿病人直接纳入MAFLD,而体重正常的成年人需要满足至少两个代谢紊乱的指标。这个新的定义和诊断标准一旦达成共识,将会给新药研发带来包括临床设计在内的重大变化,比如入组标准和临床终点的设定等。医生,专家和监管机构后续如何互动、推进NASH的重新命名,让我们拭目以待。

参考资料:
1. Etiology and therapy of fatty liver. Dtsch Med J 1972 Nov 10;23(11):648-53
2. Nonalcoholic steatohepatitis: Mayo Clinic experiences with a hitherto unnamed disease. Mayo Clin. Proc. 55,434–438 (1980)
3. The natural history of nonalcoholic steatohepatitis: a follow-up study of forty-two patients for up to 21 years. Hepatology 11, 74–80 (1990).
4. Steatohepatitis: a tale of two “hits”? Gastroenterology 114, 842–845 (1998)
5. Evolution of inflammation in nonalcoholic fatty liver disease: the multiple parallel hits hypothesis. Hepatology 2010;52:1836-1846
6. Farnesoid X receptor induces Takeda G-protein receptor 5 cross-talk to regulate bile acid synthesis and hepatic metabolism. J Biol Chem. 2017 Jun 30;292(26):11055-11069
7. MRGPRX4 is a bile acid receptor for human cholestatic itch. Elife 2019 Sep 10;8:e48431
8. MRGPRX4 is a G protein-coupled receptor activated by bile acids that may contribute to cholestatic pruritus. PNAS 2019 May 21;116(21):10525-10530.
9. Inflammasome-mediated dysbiosis regulates progression of NAFLD and obesity. Nature 482, 179-185(2012)
10. Selonsertib for patients with bridging fibrosis or compensated cirrhosis due to NASH: Results from randomized phase III STELLAR trials. J Hepatol 2020 Jul;73(1):26-39
11. Dissociation of Akt1 from its negative regulator JIP1 is mediated through the ASK1-MEK-JNK signal transduction pathway during metabolic oxidative stress: a negative feedback loop. J Cell Biol2005 Jul 4;170(1):61-72
12. Noninvasive biomarkers in NAFLD and NASH – current progress and future promise. Nat Rev Gastroenterol Hepatol 2018 Aug;15(8):461-478
13. A blood-based biomarker panel (NIS4) for non-invasive diagnosis of non-alcoholic steatohepatitis and liver fibrosis:a prospective derivation and global validation study. Lancet Gastroenterol Hepatol 2020 Aug 4;S2468-1253(20)30252-1
14. New drugs for NAFLD: lessons from basic models to the clinic. Hepatol Int 2020 Jan;14(1):8-23
15. Strain dependence of diet-induced NASH and liver fbrosis in obese mice is linked to diabetes and infammatory phenotype. Liver Int. 2014;34(7):1084–93
16. KHK inhibition for the treatment of hereditary fructose intolerance and nonalcoholic fatty liver disease: a double‑edged sword. Cell Mol Life Sci.2020Sep;77(17):3465-3466
17. Fructose stimulated denovo lipogenesis is promoted by inflammation. Nat Metab.2020 Aug 24
18. Finding the Sweet Spot:Parsing Tissue-Specific Contributions of Fructose Metabolism. Cell Metab.2020Jul 7;32(1):6-8
19. The Commensal Microbe Veillonella as a Marker for Response to an FGF19 Analog in Nonalcoholic Steatohepatitis. Hepatology 2020 Aug 13
20. MRI Assessment of Treatment Response in HIV-associated NAFLD: A Randomized Trial of a Stearoyl-Coenzyme-A-Desaturase-1 Inhibitor (ARRIVE Trial). Hepatology 2019Nov;70(5):1531-1545
21. Vitamin A signaling and homeostasis in obesity, diabetes, and metabolic disorders. Pharmacol Ther 2019May;197:153-178
22. Disturbed Vitamin A Metabolism in Non-Alcoholic Fatty Liver Disease (NAFLD). Nutrients. 2017 Dec29;10(1):29
23. A Protein-Truncating HSD17B13 Variant and Protection from Chronic Liver Disease. N Engl J Med 2018Mar 22;378(12):1096-1106
24. 17-Beta Hydroxysteroid Dehydrogenase 13 Is a Hepatic Retinol Dehydrogenase Associated With Histological Features of Nonalcoholic Fatty Liver Disease. Hepatology 2019Apr;69(4):1504-1519
25. Hsd17b13 Deficiency Does not Protect Mice From Obesogenic Diet Injury. Hepatology 2020 Aug 11
26. Targetting Mitochondria-located circRNA SCAR Alleviates NASH via Reducing mROS Output. Cell 2020 Sep16 online
27. Silencing hepatic MCJ attenuates non-alcoholic fatty liver disease (NAFLD) by increasing mitochondrial fatty acid oxidation. Nat Commun 2020 Jul 3;11(1):3360
28. A new definition for metabolic dysfunction-associated fatty liver disease: An international expert consensus statement. Journal of Hepatology 2020 vol. 73j 202–209

32. 谢雨礼演讲实录丨疾病分析和小分子新药的选品技巧(2017-07-01)
29. 药品监管倒退的忧虑:专家评论特朗普的新FDA局长(2017-04-06)


点击阅读原文,查看更多谢雨礼博士的专栏文章!
发布者:药时代,转载请首先联系contact@drugtimes.cn获得授权



 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
