
在即将过去的2020年,PD-1/L1疗法又获批了众多适应症,涉及到13类癌症,我们为大家整理了截至2020年12月最新获批的PD-1/L1疗法,同时附上各类癌症2020版CSCO免疫检查点抑制剂临床应用指南供大家参考。
试验结果表明,在96名对BCG无响应的高危患者中,Keytruda达到41%的完全缓解率(95%CI:31,51),达到完全缓解的患者中,中位缓解持续时间为16.2个月。46%的患者完全缓解时间超过12个月。
2020版CSCO免疫检查点抑制剂临床应用指南:

O+Y获批肝细胞癌
阿特珠单抗联合贝伐单抗获批肝细胞癌
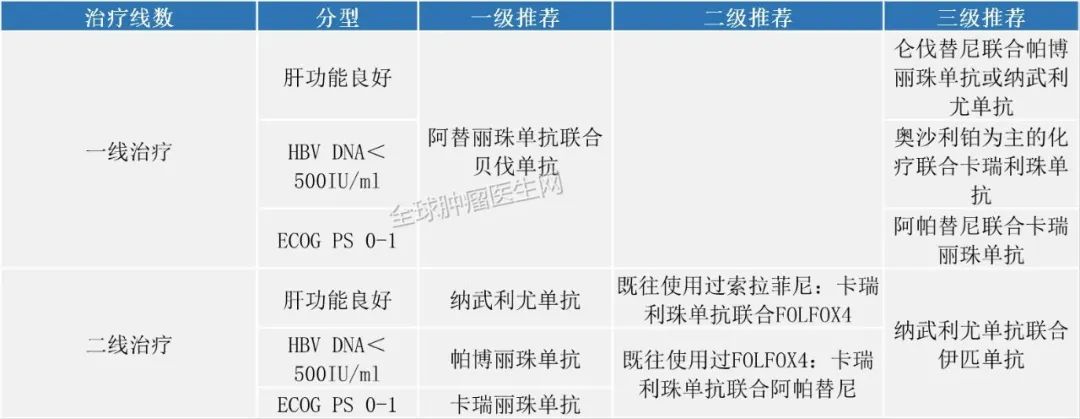

2020版CSCO免疫检查点抑制剂临床应用指南:
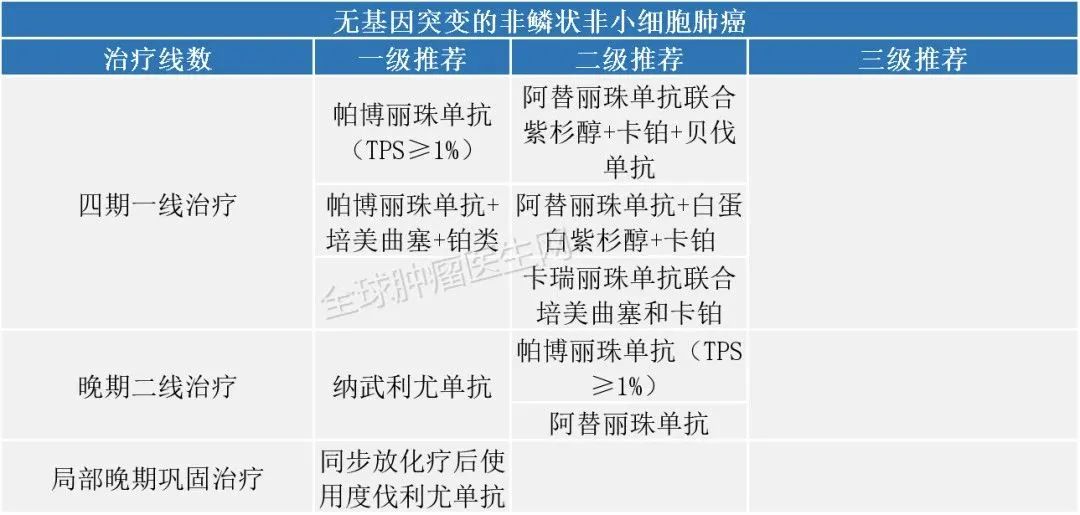
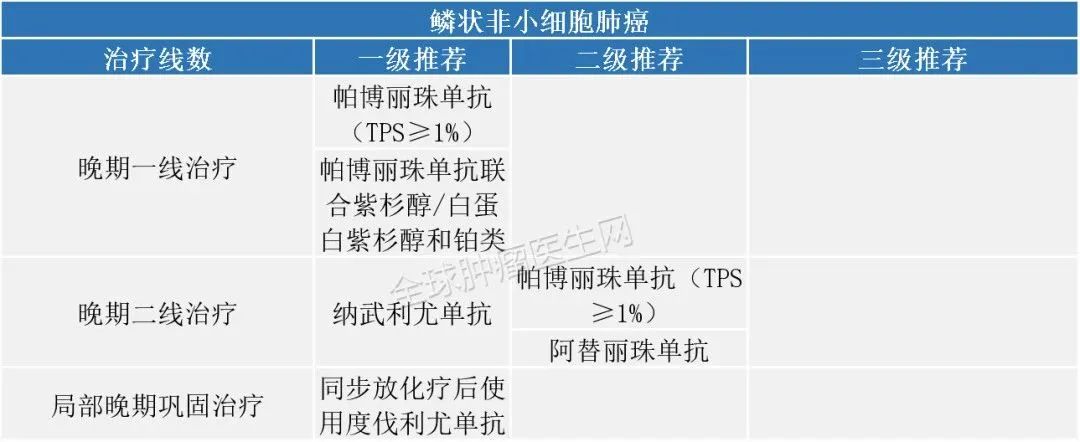




2020年7月30日,FDA批准atezolizumab联合cobimetinib(Cotellic)和vemurafenib(Zelboraf)治疗BRAF V600阳性的黑色素瘤。
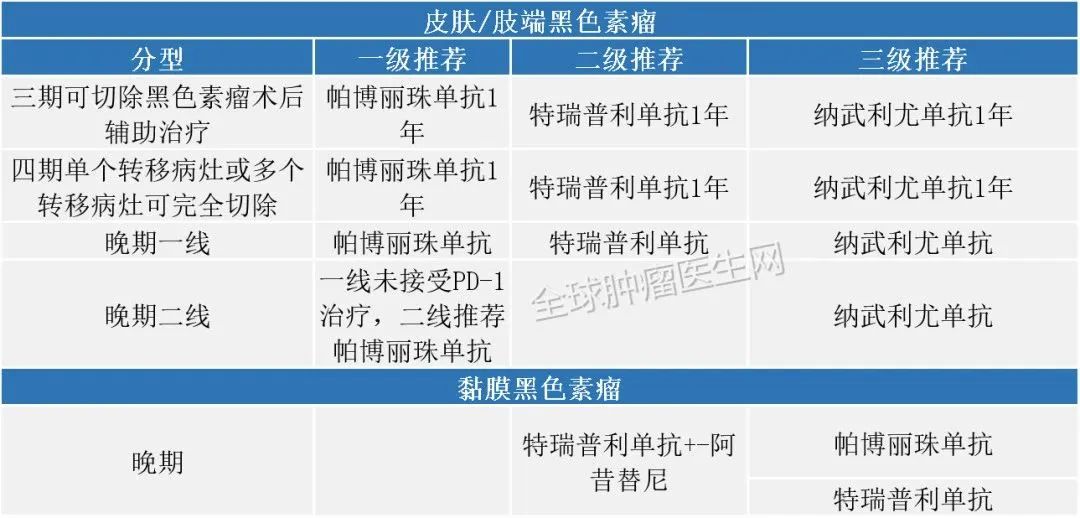


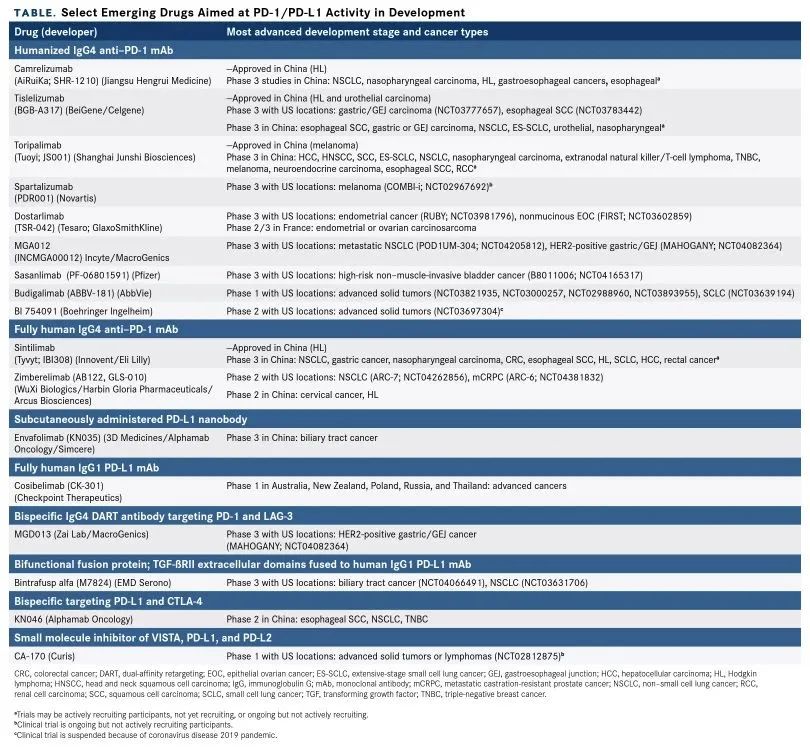
内容仅供感兴趣的个人谨慎参考,非商用,非医用、非投资用。
版权归拥有者。衷心感谢!
文中图片取自网络,根据CC0协议使用,版权归拥有者。
任何问题,请与我们联系。衷心感谢!

 点击直达,每月2万多朋友到过这里!
点击直达,每月2万多朋友到过这里!
本文转载自上海细胞治疗工程技术研究中心,本文观点不代表药时代DrugTimes立场。


 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
