

⬆️ 欢迎参加2020中国新药CMC高峰论坛!
作者 l 郭佳
沈阳药科大学制药工程博士,美国 Bruch S. Blumberg Institute博士后研究员。聚焦生物医药、医疗器械等医疗硬核股权投资。曾任职于久友资本、中钰资本、远大集团诺康生物,提倡通过资本、管理和资源的输出,运用“产学研融”四位一体化理念,促进新经济企业健康发展。
来源 l 维渡纵横(WeDimension),点击阅读原文
腺相关病毒(AAV)载体介导的基因治疗药物被批准用于遗传性失明和脊髓性肌萎缩的治疗,对其他罕见疾病,包括血友病和杜氏肌营养不良,也取得了很好的治疗效果。对AAV进行载体工程修饰可以提高AAV的转导效能(基因表达盒工程)、载体向性(衣壳工程)和避免宿主免疫应答,除此之外优化AAV的大规模生产,这些都是基因治疗药物能否成功的关键因素。
基因治疗最简单的形式是通过非病毒或病毒载体将遗传物质引入靶细胞,通过纠正或补充缺陷基因来治疗或预防疾病。基因治疗的效果可能是持久的,不需要反复干预,可以通过体外和/或体内策略实现。体外基因治疗使用从病人身上获取的靶细胞,经过基因改造后再注入病人体内。体内基因治疗将遗传物质直接导入目标器官或患者组织中。
各种类型的基因传递策略已经被用于治疗各种各样的疾病。大多数由特定基因缺陷引起的疾病(如由于编码凝血因子的基因突变引起的血友病)可以通过传递缺失的基因来纠正。由错误折叠蛋白质的毒性引起的疾病(如亨廷顿病),可以通过传递核酸(例如siRNAs)来抑制过表达的基因(即RNA干扰)来治疗。对于某些由未知基因突变引起的疾病,基因治疗可用于提供改善疾病表型的产品(例如用于湿性年龄相关性黄斑变性的抗血管内皮生长因子、感染性疾病的抗体和用于充血性心力衰竭的钙信号蛋白)。
近几十年来,病毒载体介导的基因疗法已被用于临床试验,以治疗心血管、肌肉、代谢、神经系统、血液学、眼科疾病以及感染性疾病和癌症。AAV载体是业内关注的重点,它具有有益于临床应用的独特特性,包括趋向性广、免疫原性低、易于生产;它也是非致病性的,很少整合到宿主染色体中,导致转基因的长期表达。然而,尽管AAV载体在临床中取得了可喜的治疗效果,但人们越来越关注其转导效率和人体对AAV转导细胞产生的免疫反应。
在本文中,我们将讨论如何通过“载体工程”来增强AAV载体的转导效率(基因表达盒工程)、载体向性(衣壳工程)、克服患者的免疫障碍,以及提升AAV的产量,此外介绍预测AAV基因治疗药物临床试验中转导率的方法。
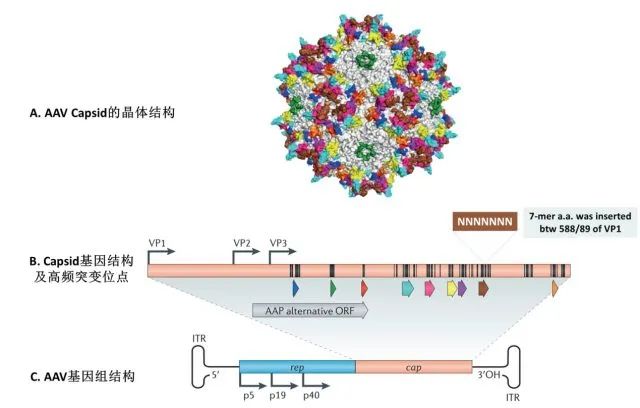
AAV是一种单链DNA细小病毒,其基因组包括rep基因和cap基因,两侧有两个末端反向重复序列(ITRs)。rep基因由单个ORF、Rep78、Rep68、Rep52和Rep40编码,帮助AAV基因组复制和病毒粒子组装。三种衣壳蛋白(病毒蛋白VP1、VP2和VP3)由单个cap ORF生成,但由一个罕见的起始密码子(ACG)转录调控和可变剪接,因此,VP1和VP2的C末端与VP3具有相同的氨基酸。此外,装配激活蛋白(AAP)对衣壳装配至关重要,它由cap基因内的一个框内折叠ORF编码。所有AAV病毒粒子均由60个VP亚基组成,VP1:VP2:VP3的比例为1:1:10。每个亚基在病毒粒子表面有9个可变区域,它们决定AAV载体的主要取向和细胞内运输,通常是中和抗体(NAbs)识别的区域。基因修饰这些可变区域可以改变AAV的转导效率和NAbs与病毒粒子表面的结合能力。
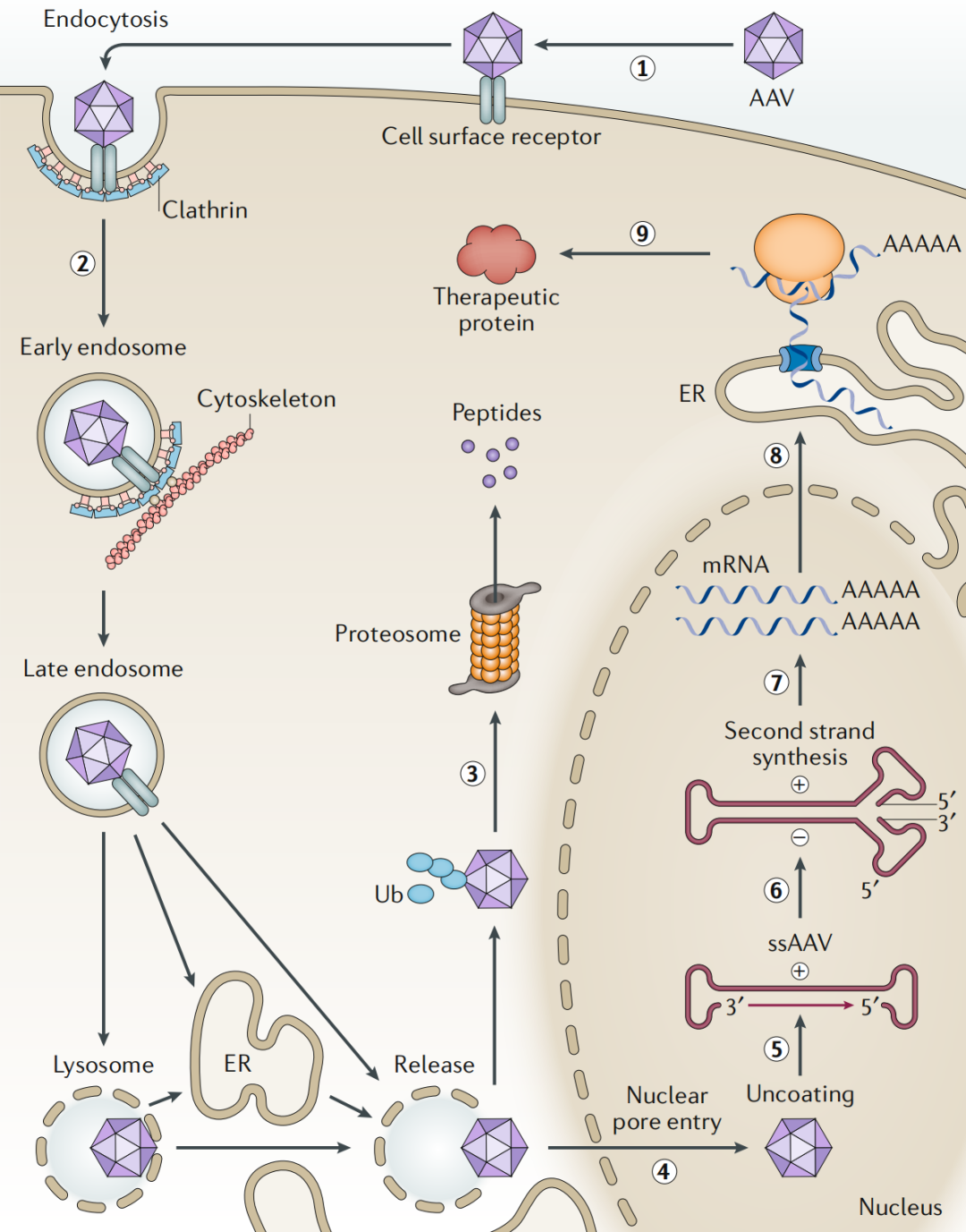
研究表明AAV通过在细胞表面结合主受体和共受体感染靶细胞,从而触发其内吞进入内小体。在结构改变暴露了VP1和VP2的N末端后,AAV病毒粒子从核内体中释放并在细胞核周围区域积累。AAV病毒粒子一旦进入细胞核,就会脱壳并释放其单链基因组,并将其转化为双链DNA (dsDNA)模板,在双链DNA模板上进行转基因的转录和翻译。
重要的是,只有145 bp的ITRs对于rAAV的增殖是必要的,ITR能够诱导转基因表达,在载体生产和确保在细胞中持久转导发挥重要作用。因此,基本上96%的AAV基因组可以被移除,以允许对AAV载体改造而进行基因治疗。
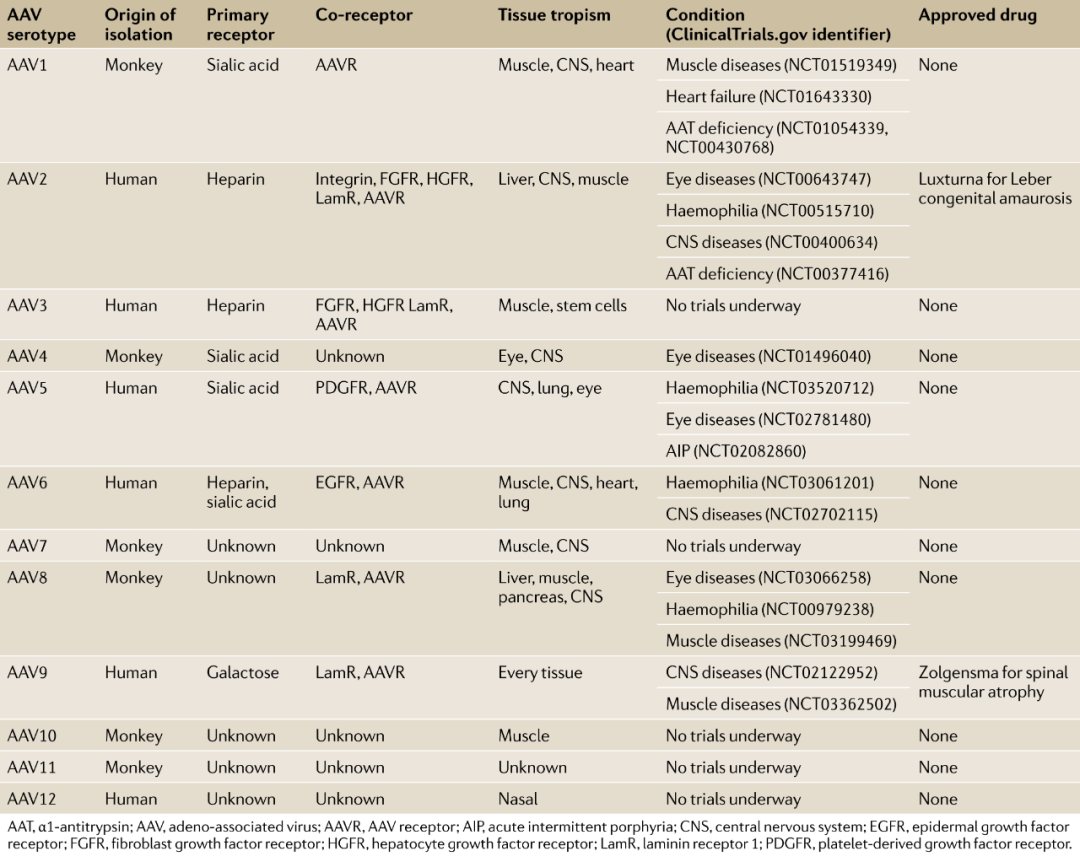
到目前为止,已经分离和研究了至少12个自然血清型和100多个变异的AAV作为基因传递载体,并从这些载体中不断生成AAV突变体,以优化AAV用于基因传递的使用。不同的AAV血清型具有不同的结合受体和组织趋向。
在rAAV转导过程中,衣壳的特异性细胞毒性T淋巴细胞(CTL)应答会清除rAAV转染的靶细胞,从而降低转基因表达导致治疗失败,而CTL反应的水平依赖于靶细胞上呈现的衣壳特异性抗原的水平,这和器官移植手术中的急性免疫排斥很类似。比如在所有血友病研究中,rAAV介导的FIX基因在患者中的表达低于临床前动物模型:给予每公斤体重1×10E11剂量的rAAV8–FIX使F9敲除小鼠血液中的FIX水平提高到野生型小鼠FIX水平的160%;然而对灵长类和人类给予每公斤体重2×10E11个rAAV8–FIX,相对于健康个体,血液FIX水平仅增加40%或<1%。
在rAAV转导成功后,基因表达盒会产生先天免疫反应,会产生类似移植手术中的慢性免疫排斥反应,导致基因治疗药物在体内发生长期毒性、表达量无法控制,并很快在体内沉默。
通过基因修饰rAAV载体即载体工程,优化AAV的基因表达盒和衣壳,可以提高AAV的转导率、安全性和体内存活时间。下文将着重分析其成药的关键因素。
载体工程包括“基因表达盒工程”和“衣壳工程”,直接影响基因治疗药物的有效性、安全性和持久性。
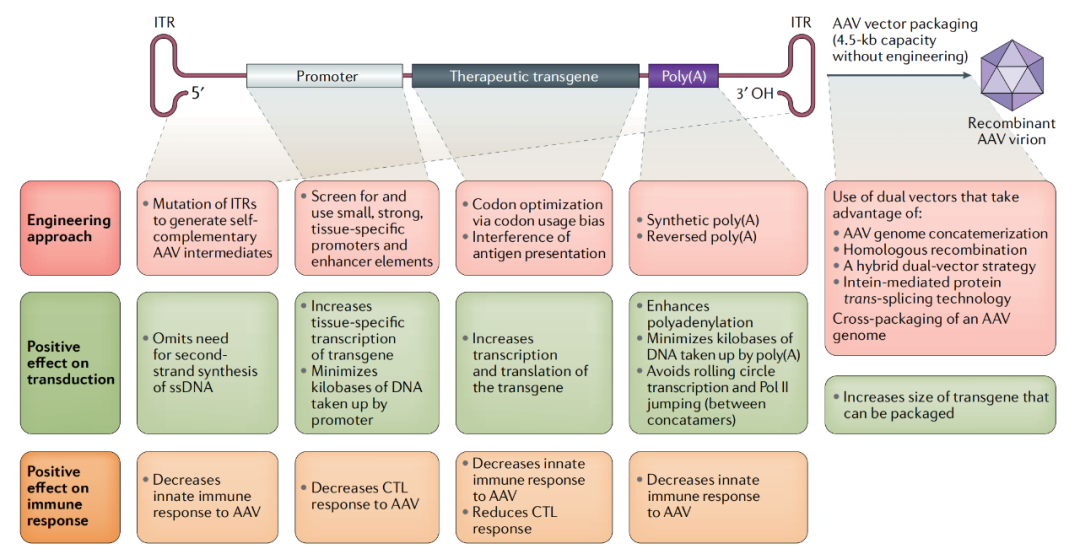
rAAV基因表达盒的设计可以在两方面增加基因治疗药物的成药性,一方面是提高目标基因的转到效率和表达量;另一方面是降低免疫排斥反应并防止转基因沉默。
AAV基因表达盒可以被设计以增强AAV的转导,并使AAV能够逃避免疫应答。通过突变AAV载体上的ITR,可以防止Rep蛋白的剪切,产生自互补的AAV载体,增强载体转导,ITRs的突变也可能降低AAV的先天免疫反应;使用小型组织特异性启动子可以增加组织特异性转基因表达和AAV基因组的包装能力,并最小化对AAV的细胞毒性T淋巴细胞(CTL)免疫反应;转基因密码子的优化增加了转基因AAV的转录和翻译,降低了对AAV的免疫应答;使用合成的poly(A)可以增加mRNA的核出口、翻译和稳定性(通过增强聚腺苷酸化),另外使用反向的poly(A)可避免ITR的转录,两种方法都增强了AAV转导,而反向poly(A)降低了对AAV的先天免疫反应;最后,使用双AAV载体或交叉包装AAV基因组可以使大体积转基因有效且有功能的表达。下文将详述基因表达盒中每个组成部分的影响。
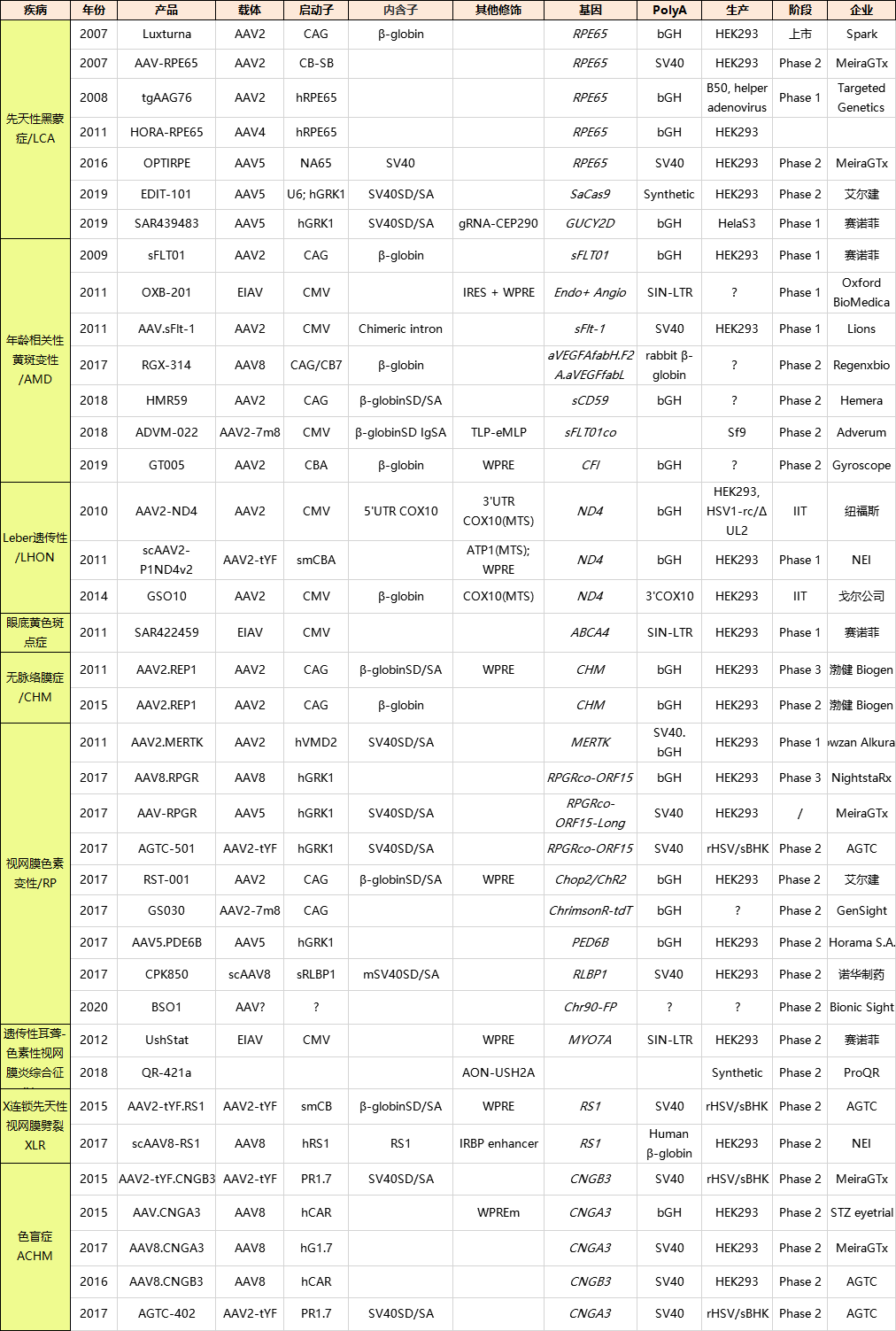
AAV转导率的限制是由于在mRNA转录开始之前,需要从单链AAV基因组合成dsDNA,这一必经的分子步骤是由ITRs启动的。通过突变一个野生型ITRs,可以克服rAAV感染后合成第二链的需要。因此,突变的ITR不适合作为Rep68和Rep78蛋白的底物,从而阻止了复制的末端分解,导致特异性的自互补AAV (scAAV)中间体的产生。scAAV中间体包含了正链和负链的DNA,当被包裹在病毒粒子衣壳中时,与野生型AAV不同,只包装了一个单链的正链或负链的DNA基因组,当scAAV中的基因表达盒被改变的ITR融合,两个互补的部分被送到细胞核时,立即退火形成dsDNA,立即发生转录。值得注意的是,由scAAV编码的GFP或FIX比传统单链AAV载体编码的GFP或FIX表达更快,表达水平更高。2019年,FDA批准了治疗脊髓性肌萎缩(SMA)的基因治疗药物Zolgensma,而scAAV载体正是其重要组成部分,该基因治疗药物由AveXis公司研发,2018年被诺华制药以87亿美元并购。
尽管ITR的合理设计增加了AAV转导效率,但scAAV载体的使用依旧是有限制的,他们只能容纳不高于2.5kb的基因表达盒,提高AAV包装能力可以进一步提高scAAV技术的应用。
首先,由于AAV的包装容量有限,必须对包括启动子在内的所有顺式元件进行优化;同时,结合不同特异性启动子和增强子元件,生成小型启动子和增强子,用于rAAV的有效包装和转导。例如,Chuah等全基因组筛选鉴定出14个肝细胞组织特异性顺式作用调节模块,长度从41-551 bp不等,包含进化保守的转录因子结合位点基序簇;含有顺式作用的调控模块元件和肝脏组织特异性启动子的rAAV基因表达盒在小鼠中的表达量是仅含启动子的rAAV的10 ~100倍。事实上,生物技术公司已经把重点放在优化基因治疗的启动子上,下一代rAAV载体可能来自模块化的组件,这些组件都已针对AAV表达进行了优化,并在临床研究中进行了测试。
近年来,越来越多的制药公司发现启动子不单单和基因表达量有关,更重要的是会影响基因治疗作为药物的安全性(免疫反应)和表达时限。启动子本身并无编译功能,但它拥有对基因翻译氨基酸的指挥作用,就像一面旗帜,其核心部分是非编码区上游的RNA聚合酶结合位点,指挥聚合酶的合成,这种酶指导RNA的复制合成,一旦该段位的启动子发生突变/变异,将对基因的表达有着毁灭性作用。
rAAV传递的转基因可引发适应性免疫反应,包括CTL反应和抗治疗蛋白异源抗体的形成,使用组织特异性启动子可以防止先天免疫反应和防止其在抗原呈递细胞中的表达并减少转基因诱导的CTL(细胞毒性T淋巴细胞)反应。研究显示,在rAAV转导成功后依旧会产生免疫应答,特别是直接选用外源性的通用型启动子如CMV、CAG等而没有任何结构的改良,会产生类似移植手术中的慢性免疫排斥反应,导致基因治疗药物在体内发生炎性反应、表达量无法控制(快速升高后急剧下降),并很快在体内沉默,这些现象虽然还没有足够多的文章发表,但是已经引起基因治疗领域的高度重视。
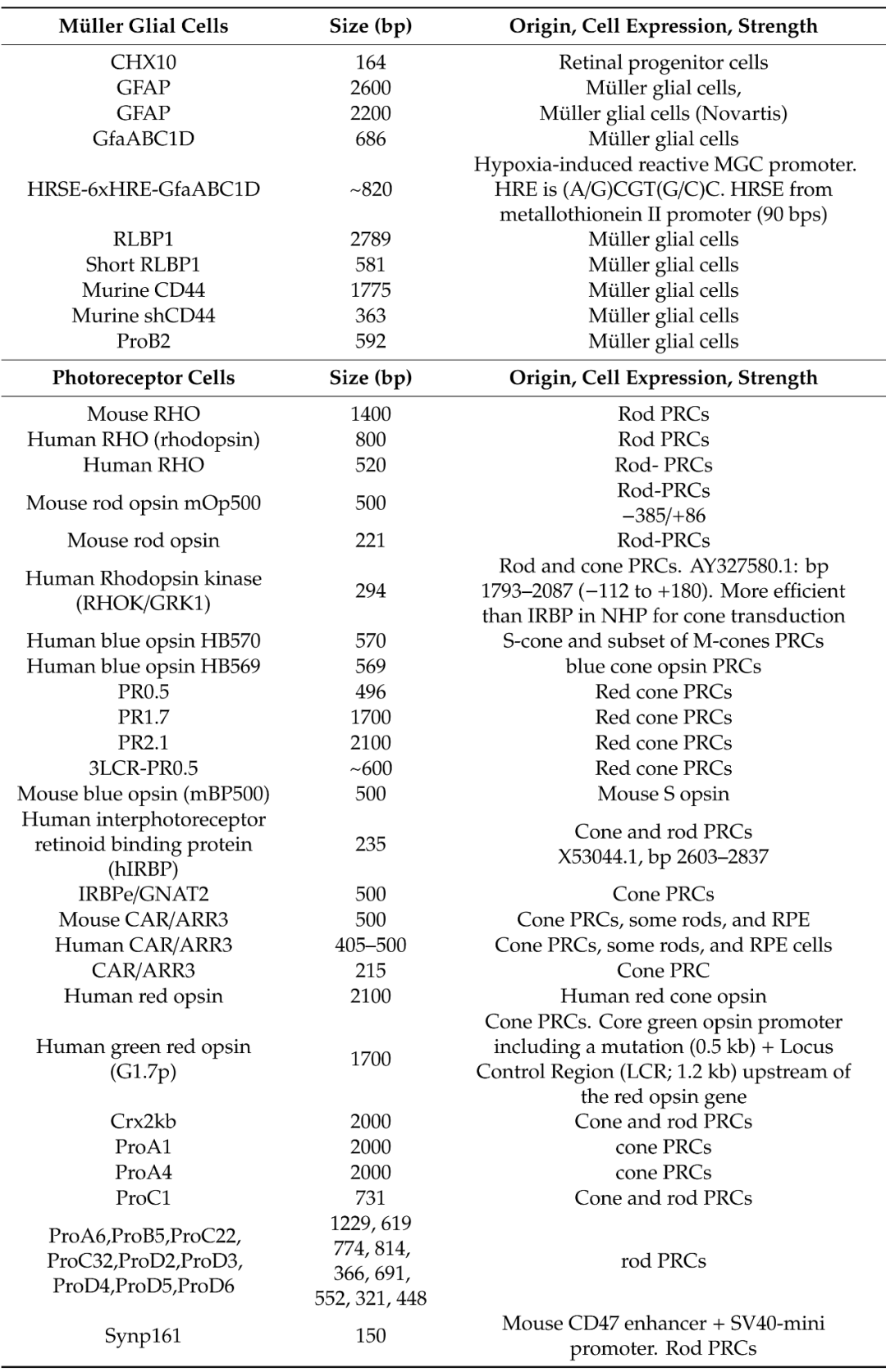
过往在rAAV载体中使用的启动子大多为单向通用型启动子,如CMV、CBA、CAG、PGK、EF-1α,来实现在细胞中的高表达;虽然设计并筛选出组织特异性启动子要比通用型启动子复杂很多,但组织特异性启动子可开启一个更具细胞特异性和自然的表达谱,增加目标基因表达效能,并且不易沉默。
例如两个rAAV-RPE65基因疗法使用了两个组织特异性启动子,一个1.6 kb长的RPE65启动子和一个缩短为750 bp (NA65p)的启动子,其中rAAV-NA65p-RPE65基因表达载体也有其他修饰(SV40内含子、Kozak序列、密码子优化)以提高hRPE65表达的效力和细胞特异性,发现在视网膜中,改造过的NA65p启动子比长启动子RPE65更少被沉默;研究显示,CMV启动子在视网膜、海马体、脊髓或黑质中起初会促进急剧表达,十周后开始出现沉默现象(在纹状体中CMV未发现快速沉默现象),而改用光感受器组织特异性启动子则在上述组织中都可持续表达;另外,由于rAAV的包装容量有限,像CBA/CAG (1661 bp)这样的长序列启动子在最近的临床试验产品中已经并不常见。
组织特异性启动子的缺陷是体积较大、目标基因表达量比CMV低,但是经过设计优化和筛选,已经有不同的组织特异性启动子应用于眼科,表达量和CMV等通用型启动子数量级相当,并且不易在体内沉默。
高光坪教授在其2019年发表的综述中提到,特异性表达是基因治疗的一个重要方面,在脱靶组织或细胞类型中的基因表达可能导致毒性或触发不必要的免疫反应。从rAAV基因组设计的角度来看,最好的策略就是让基因在特定部位持续表达,需要通过使用组织特异性启动子和/或融合miRNA的3ʹ-UTR结合位点,这涉及到承载高水平miR-142-3p的抗原呈递细胞,在基因表达盒中包含miR-142-3p结合位点,可以有效降低抗原呈递细胞中转基因的表达,并极大地降低对转基因产物的免疫排斥反应。
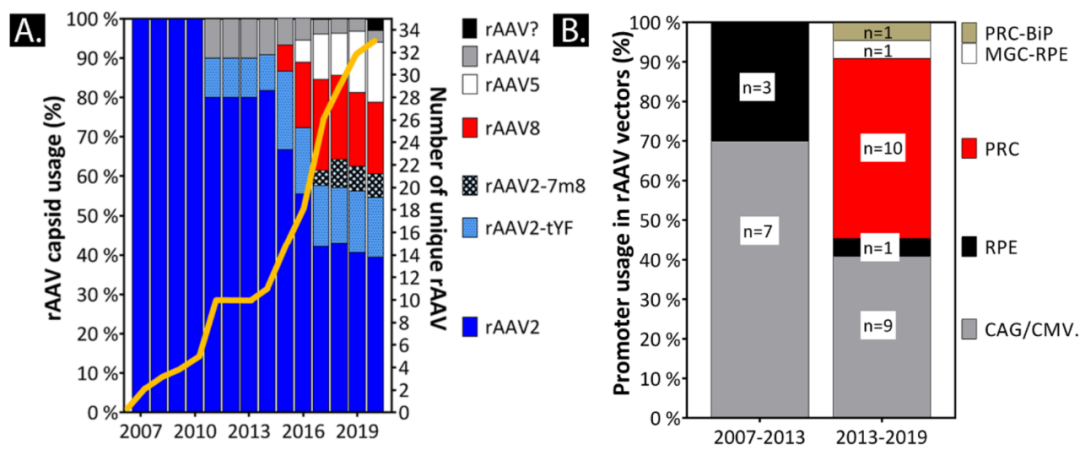
Jan Wijnholds教授在其2020年发表的综述中总结到,在2013年之前,全球使用的均为通用型启动子CAG或者CMV或者改造的CAG,在2013年以后,越来越多的基因治疗选择组织特异性启动子。
笔者也统计了十三年来眼科基因治疗应用的启动子、内含子、PolyA的选择情况和临床实验进展。
2019年8月13日,AAV基因疗法的Asklepios BioPharmaceutical (AskBio) 宣布收购Synpromics,Synpromics致力于基因控制合成启动子技术、生物信息学和智能数据驱动设计领域,以实现更精确的细胞靶向和基因表达,该公司的启动子(Promoter)技术和制造系统授权给其它基因治疗公司以获得商业权益。AskBio成立于2001年,由Jude Samulski博士、华裔科学家肖啸博士和Sheila Mikhail博士联合创立。
截至目前,通过公开数据得知,目前国内至少有3家应用组织特异性启动子的基因治疗公司,分别为信念医药、诺洁贝、傲业生物。
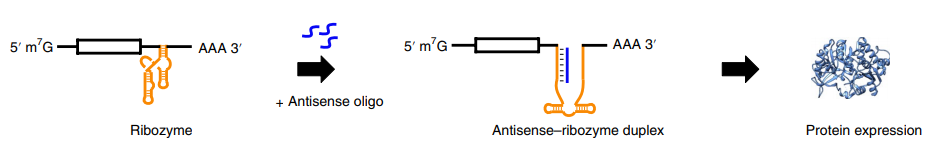
另外,基因治疗一直被认为存在固有的风险,因为一旦它们被传递到患者的细胞中,就永久性的改变了患者的遗传物质且无法被关闭或调整。因此,诱导型基因治疗也开始在临床上应用,基本思路是开发具有基因开关作用的诱导型启动子。美国斯克里普斯(Scripps)研究所的Michael Farzan博士和其团队发现了一种可逆性的RNA开关,可通过注射反义吗啉环寡核苷酸( morpholino)在体内调控AAV转基因的表达。这一研究成果于2019年12月23日发表在《Nature Biotechnology》上,为基因治疗开发者提供了可行的技术来调整治疗性基因的活性水平。这一技术似乎解决了一个主要的安全问题,从而可能使这种基因治疗策略得以更多地使用。国内叶海峰团队也开发了一种阿魏酸调节的基因开关。在应用方面,国外的Intrexon和Ziopharm已经将诱导型基因治疗推进到了II期临床研究。
临床试验中使用的大多数治疗性转基因来自于自然基因序列,自然基因序列的密码子没有优化。对于优化密码子,宿主物种的整个基因组cDNA被用来驱动有机体的密码子使用偏性(这通常反映了个体tRNA的浓度)。后来的研究发现,tRNA浓度在组织和细胞类型之间存在差异,为优化特定组织的基因治疗药物结构,一项研究检查了组织特异性和细胞类型特异性密码子使用偏好表,用于密码子在肝脏中的优化,结果显示在人肝细胞系和小鼠肝脏中,编码FVIII的rAAV载体的密码子优化序列比含有野生型FVIII序列的rAAV载体诱导的FVIII表达水平更高。当rAAV载体被开发用于临床研究时,密码子的使用多是标准优化。大多数供应商都会优化密码子,然而值得注意的是,同一个基因经过不同供应商优化后,表达量会比野生型序列增加2-9倍不等,这些观察结果表明,我们对优化转基因密码子的理解还远远不够,进行测试时应该谨慎看待。
许多转基因,比如编码肌营养不良蛋白的基因(治疗杜氏肌萎缩症所需的基因),FVIII(用于治疗血友病A)和视网膜特异性磷脂转运ATP酶ABCA4(用于治疗视网膜变性疾病如黄斑变性疾病)等,由于体积太大而不能有效地包装成AAV病毒粒子。一些大体积转基因在剪切后已被用于临床试验并获得了成功,近年科学家们也开发了其他一些策略,可以使用AAV载体在动物体内传递更大体积的转基因。
第一种方法是利用AAV传递后,通过ITR序列的同源重组将AAV基因组合并。大体积的基因表达盒可以分到两个或更多的载体,并运送到相同的细胞,病毒在细胞核中脱壳后,片段之间同源重组形成完整的转基因组。这种方法已经在动物身上成功地传递了2-3个独立的AAV载体,并成功表达了功能性肌萎缩蛋白。
第二种方法是,被截断的基因片段在载体基因组上不限定的位置被包装成不同的AAV病毒粒子,AAV病毒粒子的混合群体中含有不同长度的截断基因片段,这些转导后的双重AAV载体,通过将两个不同的AAV载体基因组重叠区域进行同源重组,或者通过单链模板将不同的AAV载体基因组在互补区域进行退火,从而产生完整的基因表达盒。特异性的重叠片段也可以添加到每个AAV载体的末端,促进同源重组。
第三种方法是为了克服前两种方法的局限性,上述方法缺陷在于共聚合可以得到无功能的重组产品,使用截断的重叠基因片段会在转基因的中间部分产生一个不需要的ITR结构。杂交双载体策略结合了重叠区域和内含子剪接位点,这种方法依赖于AAV基因组的共聚合活性,通过重组将独立的AAV载体基因组聚合到一起,以确保转导后产生正确的转基因蛋白,这一策略可能会增加全功能蛋白的表达。
第四种方法是将AAV基因组交叉包装到其他细小病毒的衣壳中。
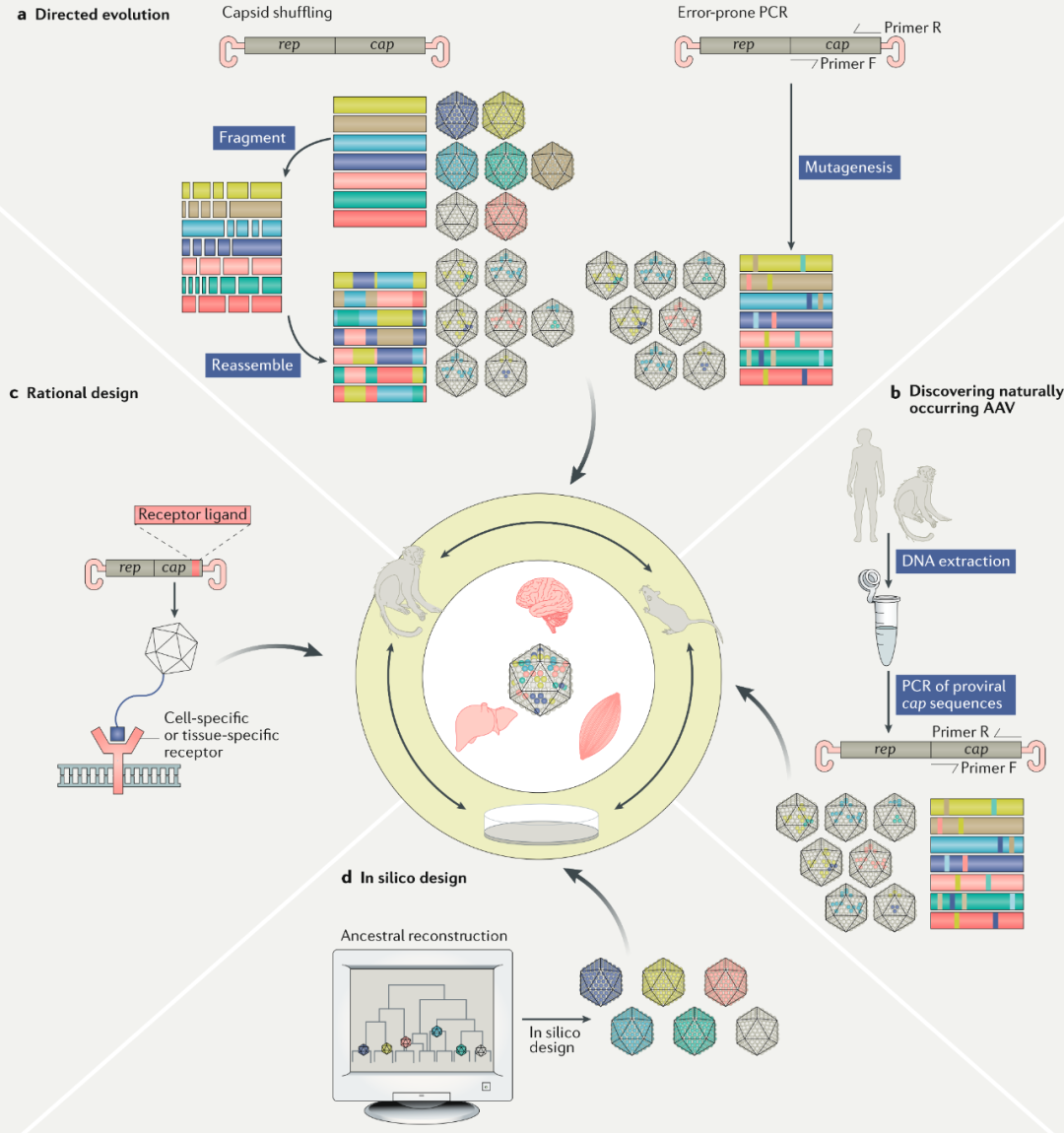
除了自然发现的AAV,设计AAV衣壳的主要技术有三种:合理设计、定向进化和计算辅助设计。
定向进化是模拟自然进化的机制,在衣壳蛋白中引入大量随机突变,然后在选择压力下筛选出具有特定生物性质和特征的衣壳。另外,在离散区域或整个cap基因上的易错聚合酶链反应(error-prone PCR)也是筛查生成衣壳库的一种可行方法。
AAV最初被发现为细胞培养污染物,这就是最广泛使用的血清型AAV 2;目前最具有临床应用潜力的AAV血清型都是从天然来源中分离出来的,其中的典型范例就是AAV9,它是从人类肝组织中分离出来的。目前已经分离和研究了至少12个自然血清型,如下表所示。
流行病学分析表明,40%-80%的人血清抗AAV抗体呈阳性反应,这表明人源性衣壳可能并不是最理想的基因治疗载体,因为已经存在的AAV衣壳免疫可能会降低传导效率。解决这一难题的策略包括使用从非人灵长类中分离的AAV衣壳,以及其它脊椎动物中分离的AAV衣壳蛋白。目前,从非人灵长类动物和猪身上获取的AAV衣壳种类在实验中表现出良好的转基因递送能力。
合理设计是改良病毒载体衣壳的首选策略之一,第一种方法是将特定多肽序列嫁接在衣壳表面,让它们可以与特定细胞表面的受体相结合。
另一种方法是扰乱细胞对衣壳蛋白的降解过程。定点突变表面暴露的酪氨酸残基,通过抑制蛋白酶体降解和促进细胞内转运,促进靶细胞转导。
生物信息学和计算机工具可以通过比较不同AAV的衣壳蛋白序列,推断出衣壳蛋白的进化过程,并且发现衣壳蛋白上具备高度多样性的区域。结合高通量测序,可以使用生物信息工具来设计衣壳变异库,以确定允许操作的高变异性区域。
美国生物技术公司 Dyno Therapeutics 推出其专有平台“CapsidMap”,该平台把 AI 运用在当前的基因治疗技术中,可以设计新颖的腺相关病毒(AAV)载体,公司宣布与诺华和 Sarepta Therapeutics 达成了合作关系,共同开发针对眼部疾病、神经肌肉和心血管疾病的基因疗法。
虽然AAV载体已成功应用于临床研究,但宿主免疫反应是其诱导有效且长期治疗性基因表达的主要障碍。临床试验数据提示AAV载体在低剂量给药时,免疫反应不强烈,但在高剂量给药时可能引起较为强烈的炎症免疫反应,对组织器官表现出毒性效应(也有报道称发现独立于炎症之外的毒性),此外免疫反应还会抑制其药效。
免疫反应主要包括适应性免疫反应(adaptive immunity)如CTL应答、NAbs和对AAV转导后的先天免疫反应(innate immunity)。
中和抗体(NAbs)结合到腺相关病毒(AAV)载体病毒粒子的表面,以防止AAV病毒粒子与靶细胞相互作用并进入靶细胞,并阻止AAV病毒粒子在细胞核内的有效的细胞内运输和脱壳(1);AAV病毒粒子通过内吞作用进入细胞后,在核内体中降解,使AAV基因组或衣壳暴露于toll样受体9 (TLR9)或TLR2等受体,通过MYD88驱动途径触发先天性免疫应答,需要注意的是,不同类型的细胞可能包含不同的先天免疫传感器(2);一些AAV病毒粒子能成功逃脱核内体进入细胞质,它们的衣壳在蛋白酶体中被泛素化并降解为小肽和表位(3);这些小肽和表位被装载在MHC I类分子上,呈现在靶细胞表面,使细胞被识别,并最终被特异性细胞毒性T淋巴细胞(CTL)反应所消除(4);AAV病毒粒子到达细胞核并脱壳(5);转录发生,正链和负链RNA由AAV基因表达盒的ITRs生成,并输出到细胞质中形成双链RNA(6);双链RNA被dsRNA传感器MDA5/RIG-I识别(7),激活了先天免疫反应(8);转基因表达后,任何错误折叠的蛋白在蛋白酶体中被降解(9),产生的小肽和表位再次结合MHC I类并触发CTL对转基因组的反应,以至于AAV转导的靶细胞可被转基因特异性CTL识别和清除(4);最后,治疗产物可被分泌到循环中,并被抗原呈递细胞吸收以激活B细胞,产生抑制剂,通过体液免疫反应中和治疗蛋白(10)。
先天免疫反应的强弱是影响整个免疫反应的关键因素,抑制AAV基因治疗的先天免疫反应策略,有助于降低炎症副反应,对提高AAV基因治疗的安全性及长期有效性具有重要意义。
研究显示,衣壳和基因表达盒均能引起先天免疫反应,AAV衣壳可能在核内体中被降解,释放AAV基因表达盒,使其能够被TLR9识别。AAV基因组及其衣壳诱导的先天免疫反应主要是由于TLR2和TLR9的模式识别,scAAV载体比传统单链AAV载体引发更强的反应;近期研究结果显示,基因组的dsRNA也许作为病原体相关模式参与了针对AAV载体的先天免疫,这也是为什么临床实验给药AAV载体数周后才出现的免疫反应,具体原因是AAV载体的ITR也可作为启动子启动基因表达盒dsRNA的表达,dsRNA可以被MDA5/RIG-I识别,从而激活转录因子NF-κB和IFN的表达,触发先天免疫反应,所以基因表达盒中的各个元件需要特殊设计才能有效规避先天免疫反应。
对于有效规避先天免疫反应的手段,目前主要在于阻断或干扰TLR的模式识别、设计基因表达盒的ITR和组织特异性启动子。
在TLR9缺乏的小鼠中已经观察到高水平的转基因表达,这促使几个研究机构修整或突变基因表达盒以减少或干扰其TLR9模式识别,例如,通过设计AAV基因表达盒来降低TLR9对其CpG位点的识别,肌肉注射CpG缺失的AAVrh32.33载体后,在效应T细胞浸润较少的情况下实现持久性转基因表达,这种策略已经在血友病患者的临床试验中使用,尽管没有足够的数据来判断它的获益。另一种干扰先天性免疫应答的策略是基于某些寡核苷酸可以干扰TLR9-靶点结合的识别,整合寡核苷酸,如来自端粒的(TTAGGG)4序列,进入AAV基因表达盒中,降低了小鼠TLR9介导的先天免疫应答,增加了AAV转导效能。这两种工程方法都需要对AAV载体盒做最小的改变,以增强载体在动物中的转导,目前尚不清楚哪种更优或者合并这些方法是否会产生协同效应。
值得注意的是,近来研究发现,在使用AAV基因治疗后6-10周,部分患者的转基因编码蛋白水平下降,这可能和衣壳特异性的CTL可以消除AAV转导的靶细胞和在AAV转导完成后基因表达盒的先天免疫反应有关,基因表达盒转录形成的dsRNA介导的先天性免疫应答可能是导致晚期治疗失败的原因之一。研究显示,在AAV长期转导后,灵长类视网膜组织中几个参与先天免疫应答的基因(包括MDA5)均被上调,减弱或消除ITRs的启动子功能,或设计特殊基因表达盒来阻断ITR的转录,可以减少dsRNA的形成,并可能消除这一担忧;或者针对dsRNA传感器或其下游信号通路的短发夹RNA克隆到AAV盒中,以阻断dsRNA介导的先天免疫应答的激活;或者选择合适的组织特异性启动子降低先天免疫反应,有助于降低炎症副反应,已有研究显示组织特异性启动子可以避免AAV对视网膜的组织破坏和炎症反应的发生,但具体的机制还在研究和探讨之中。
AAV传递的转基因可引发适应性免疫应答,包括CTL应答和抗治疗蛋白异源抗体的形成,使用组织特异性启动子可以限制AAV病毒粒子转导到靶细胞(例如在肌肉或肝脏中),阻止其在抗原提呈细胞中的表达,降低转基因诱导的CTL反应。
由于主要组织相容性复合体(MHC) I类通路主要以抗原的形式呈递转基因产物,阻断该通路可能会阻止CTL对转基因的反应,事实上,从病毒中提取的小肽,如从巨细胞病毒中提取的独特的短US6糖蛋白和从单纯疱疹病毒中提取的感染细胞蛋白47 (ICP47),可以通过多种机制抑制MHC I类通路,将编码这些病毒肽的基因融合到AAV转基因细胞中,以避免CTL介导的消除。
另外,引入内源性miRNA介导的调控机制,在抗原呈递细胞中下调转基因表达,降低基因表达CTL反应。
根据已发表的研究,>90%的人感染了AAV,约50%的人可能有中和抗体(NAbs)。对于需要全身使用AAV载体才能成功治疗的患者,例如患有神经系统疾病和肌肉紊乱的患者,NAbs尤其成问题。
非遗传学的方法来降低NAb水平包括使用药物,如利妥昔单抗和雷帕霉素,阻止B细胞产生NAbs;或通过单采血浆技术(Plasmapheresis),减少NAbs血滴度;或使用脂质体或细胞来源的胞外囊泡覆盖AAV抗原表位,防止他们被NAb识别;然而,这些策略要么效率低,要么改变AAV生物学特性,要么增加AAV衣壳抗原载量。
对AAV衣壳直接进行基因改造以避开NAbs可能是最优的选择,科学家们正尝试使用合理设计和定向进化的AAV衣壳来做到这一点。
对AAV病毒粒子如何与特异性单克隆抗体相互作用的进一步了解,使我们能够合理设计出更多能够逃脱NAb活性的AAV突变体,不影响载体的产生、转导效率或组织趋向性。AAV颗粒上的NAb识别位点可能在进化上是保守的,并位于一个特定的区域,该区域残基的合理突变可以使突变病毒规避NAbs的识别。例如AAV2单克隆抗体A20识别AAV2衣壳的多个残基,包括VP1的265残基区域,并阻断AAV2转导,通过合理的设计,AAV2衣壳被设计成AAV2.5,它在VP1的265残基处发生突变,使A20无法识别或阻止A20对细胞的转导。
定向进化也被用于分离AAV突变体。例如在采用易错聚合酶链反应(error-prone PCR)方法,产生AAV2衣壳随机突变文库,在AAV抗体阳性的人血清中筛选后,分离出对HEK293细胞具有高趋向性和能够逃避NAbs的突变体。
通过合理设计,AAV衣壳也可以被设计用于避免衣壳特异性CTL反应。AAV转导导致衣壳抗原在靶细胞表面交叉呈递,这种交叉呈递由MHC I类抗原呈递途径介导,由泛素介导AAV衣壳降解。AAV衣壳中赖氨酸残基的泛素化能被蛋白质磷酸化促进,赖氨酸残基或酪氨酸或丝氨酸磷酸化位点的突变会增强AAV在细胞中的转导。此外,AAV衣壳的磷酸化位点突变,以避免泛素化和蛋白酶体介导的衣壳降解,逃脱了衣壳特异性CTL介导的对转导的靶细胞清除。
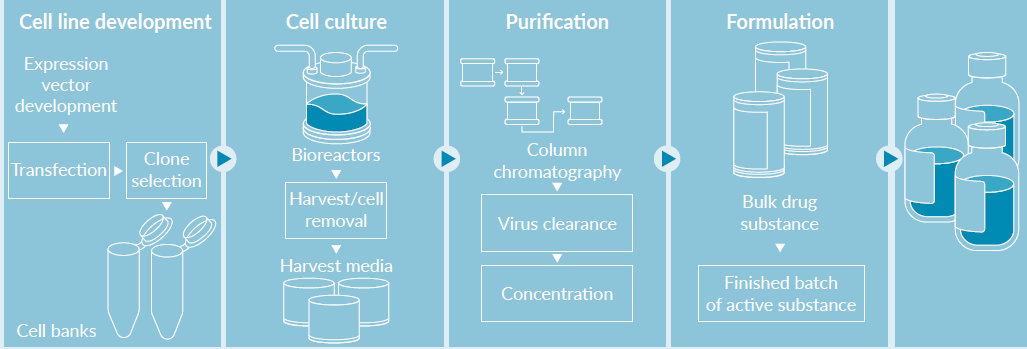
工业界正在努力帮助科学家将基因疗法快速推向市场,已经开发出一些产品来支持质粒和病毒载体的生产。
制造足够的AAV载体用于临床试验是一个挑战,特别是对于治疗神经或肌肉疾病的基因治疗,通常每公斤体重使用>1×10E14的剂量。目前AAV载体制备常用的方法为三质粒共转染HEK293细胞;另外一种是使用昆虫细胞-杆状病毒表达载体系统(BEVS)。
AAV载体通常在HEK293细胞中产生,通常利用三个独立的质粒:一个顺式载体质粒编码AAV反向末端重复序列和目的基因,一个反式质粒编码AAV的rep和cap基因,一个辅助质粒通常编码腺病毒的辅助基因。质粒通常在重组的大肠杆菌(E.coli)中发酵生产,载体和宿主菌株的筛选结合生长条件的优化(培养基和发酵条件)可有效地提高质粒产量。当使用摇瓶和WAVE生物反应器时,HEK293细胞无血清悬浮培养比贴壁的HEK293细胞产量更高,采用无血清培养基,因为其降低了添加血清的潜在污染风险,使用更符合cGMP的要求,常用于临床应用AAV载体的制造,已获批上市的治疗先天性黑朦病药物Luxturna即由Spark Therapeutics使用该方法生产。研究人员也在发展其他稳定生产的细胞系,但目前仍处于研究阶段。
用BEVs载体感染Sf9昆虫细胞进行rAAV生产是用杆状病毒Baculovirus携带Rep/Cap基因及ITR基因组,去感染悬浮培养的SF9昆虫细胞,包装出rAAV。该系统可通过穿梭载体灵活装载外源基因的片段,并在细菌内高效重组到杆状病毒基因组上,再将抽提出的重组杆状病毒基因组DNA经转染Sf9昆虫细胞,产生有感染活性的重组杆状病毒。然后,利用重组杆状病毒(BEV)感染悬浮培养的Sf9细胞生产rAAV,上市药物Glybera就是用的这种方法。
此外还有稳定细胞株生产方法,建立起含有rAAV的Rep/Cap基因或ITR基因组的稳定细胞株(常用Hela细胞),再用辅助病毒来感染生产出rAAV。此方法的缺点是稳定细胞株的建立与鉴定需要很长时间,需要注意细胞株多次传代后的稳定性。
AAV生产面临的主要挑战源自AAV载体本身,例如空衣壳或包装不完全的衣壳。空衣壳不包含DNA,输注给患者时可引起免疫毒性。包装不完全的衣壳可与完整衣壳竞争以感染患者的细胞,给药剂量中非活性病毒的衣壳的量越大,患者为达到治疗效果所需的药物总剂量就越高,给药剂量越高,发生严重副反应的风险越高。
目前提纯AAV的技术有两种:密度梯度离心和亲和层析纯化,组合这些方法可以确保更高纯度的AAV产品。几种AAV配体已被用于亲和层析、包括肝素、粘蛋白、A20单克隆抗体、AVB琼脂糖亲和树脂;利用AAV衣壳表面的表位进行纯化也进行了探索;例如,AAV载体可以被生物素化或改造编码hexa组氨酸标签(His6标签),分别用抗生物素蛋白或Ni-NTA柱进行纯化;某些AAV血清型对于AVB琼脂糖亲和树脂的亲和力能够通过合并具有最高亲和力的AAV血清型的关键残基而被增强,同时不影响载体的转导效率。由于AAV工程一般不会明显改变其分子量和结构,对AAV衣壳进行基因修饰虽然会影响亲和层析,但不太可能影响密度梯度离心。
值得注意的是,由于空衣壳或包装不完全的衣壳和含载体的衣壳具有相同的氨基酸组成,亲和层析不能区别它们(离子交换层析除外)。AAV空衣壳被用作诱饵来阻止NAbs识别含有载体的衣壳,尽管它们增加了AAV衣壳的抗原载量,可能引起不必要的免疫反应。近年来,开发了一种新型的亲和层析和离子交换层析双柱纯化平台,该平台可与多种AAV血清型兼容,该方法制备的AAV载体纯度高,空衣壳污染少。
虽然在AAV载体工程方面取得了进展,但是在一些动物模型中显示阳性结果的rAAV可能在其他物种中无效,而由于直接在人体内实验又是是不切实际和不道德的,因此需要开发能够评估AAV转导和预测载体在人体试验中的有效性的系统。
虽然多种动物模型已被用于评估治疗效果、毒性和对AAV基因治疗的免疫反应,但小鼠模型的结果不能对大型动物、人类甚至其他小鼠品系进行100%的推断。例如,用于治疗小鼠血友病的类似剂量的AAV载体,在大型动物和人类中分别降低了10倍和100倍的治疗效果;此外,从C57BL小鼠的大脑中分离的AAV PHP.B对这些小鼠脑的转导效率比AAV9更高,但并没有改善对其他小鼠品系或动物物种大脑的转导。为了克服这些问题,科学家建立了人源化的小鼠模型来测试rAAV血清型和rAAV在含有人类组织的小鼠中的转导效率。
类器官或3D组织培养系统可用于评估AAV的转导效率。类器官是由特定细胞分化而成的体外三维微型器官,用于研究疾病的发病机理和治疗方法;由于类器官由人体细胞产生,它们可能比动物模型更能反映人体的生理状况,但到目前为止,所有的类器官模型都表现出胎儿样组织表型,这可能限制了它们在评估AAV转导效率方面的应用。
AAV基因疗法在临床应用中依旧面临着挑战,包括人类的转导效率低于在动物模型中的转导率、AAV衣壳或转基因组的免疫反应、低效的AAV病毒生产和纯化方法、缺乏可靠的系统来评估预测人体临床试验的AAV转导效率以及高昂的生产纯化成本。AAV的载体工程有可能克服这些障碍,我们也确实看到AAV衣壳工程可以增加AAV的转染性,使AAV能够逃脱NAbs;基因表达盒工程可以增加转基因的表达并防止先天免疫反应和适应性免疫反应。越来越多的动物模型和类器官模型被开发和应用,将会为基因治疗从动物到人体的转导率预测提供更多的有力手段。
将AAV转化为基因治疗载体的过程需要分子生物学、生物信息学、传染病学、结构生物学、免疫学和基因组学等多学科的联合研究。随着国内科技水平的不断提高和政策的大力支持,近两年来越来越多的海内外基因治疗科学家成立创业公司,出现了诸如信念医药、赋源生物、嘉因生物、诺洁贝、至善唯新、傲业生物、纽福斯、辉大基因、克睿基因、中因科技、安龙生物、和元生物、五加和、派真生物、源兴基因等公司,掀起国内基因治疗的浪潮。
参考资料:
[1] Chengwen Li,R. Jude Samulski. Engineering adeno-associated virus vectors for gene therapy. Nat Rev Genet . 2020, 21(4):255-272.
[2] Dan Wang, Phillip W L Tai, Guangping Gao. Adeno-associated virus vector as a platform for gene therapy delivery. Nat Rev Drug Discov. 2019, 18(5):358-378.
[3] Thilo M Buck ,Jan Wijnholds. Recombinant Adeno-Associated Viral Vectors (rAAV)-Vector Elements in Ocular Gene Therapy Clinical Trials and Transgene Expression and Bioactivity Assays. Int J Mol Sci. 2020, 21 (12): 4197.
[4] Yidan Wang , Shuyong Liao , Ningzi Guan , Yuanxiao Liu , Kaili Dong , Wilfried Weber , Haifeng Ye. A versatile genetic control system in mammalian cells and mice responsive to clinically licensed sodium ferulate. Sci Adv. 2020, 6(32): eabb9484.
[5] Guocai Zhong, Haimin Wang, Wenhui He, Yujun Li, Huihui Mou, Zachary J Tickner, Mai H Tran, Tianling Ou, Yiming Yin, Huitian Diao, Michael Farzan. A reversible RNA on-switch that controls gene expression of AAV-delivered therapeutics in vivo. Nat Biotechnol. 2020, 38(2):169-175.
免责声明
内容仅供感兴趣的个人谨慎参考,非商用,非医用、非投资用。版权归作者。衷心感谢!
本文为转载,药时代持中立态度,请理性阅读
版权声明:文中图片取自网络,根据CC0协议使用,版权归拥有者。
任何问题,请与我们联系。衷心感谢!
新冠疫情的IPO热潮,众多生物技术公司相继入场,谁高歌猛进,谁又黯然失色?
本文转载自维渡纵横,本文观点不代表药时代DrugTimes立场。










 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
