药物联用已经有很长的历史了。从20世纪40年代第一批联合药物获得批准以来,这些获批药物的数量一直处于高速增长中。在非肿瘤领域疾病联合治疗药物,近20年批准了100多种。在肿瘤领域,正常批的加上off-label用的更是花样繁多。
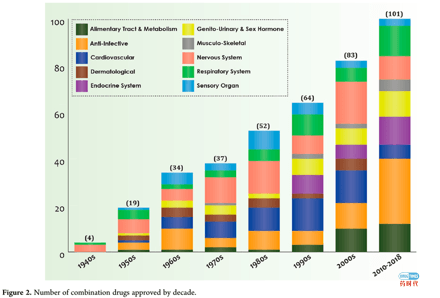
药物研发的历史来看,肿瘤的联合用药其实跟单个新药的发展息息相关。在靶向药出现之前,大家热衷的是第一代的化疗药的联用,当靶向药出现后,大家又开始探索靶向药物的联用。后来,生物药兴起,免疫治疗开始风生水起,制药界快速进入了PD1/PDL1+的时代。从Clinical Trial上分析一下肿瘤的临床试验(下图),会发现基本上处于化疗药、靶向药与PD1/PDL1组合的状态,竞争主赛道已经变的十分拥挤。
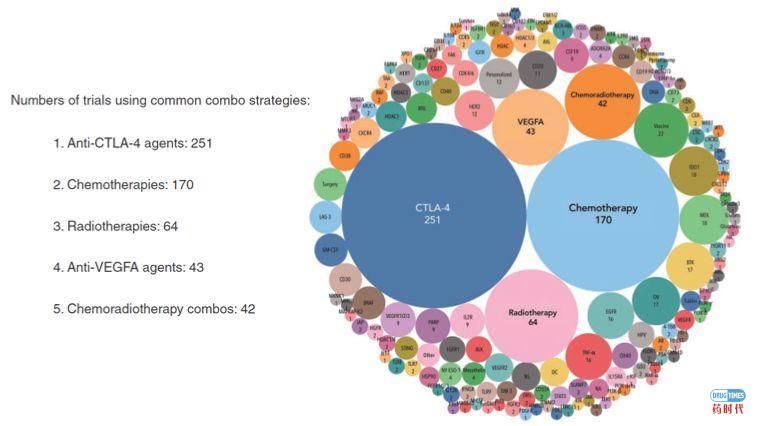
残酷得事实告诉我们,药物联用这条路已经开始走偏了。
以肿瘤免疫疗法为例,美国进行的2000多个肿瘤免疫疗法的临床试验中,90%以上都是研究PD-1/PD-L1与其他疗法的组合。陈列平教授不久前在接受采访时曾经表示,把现有的疗法与抗PD-1疗法结合一下,基本上都是随机的组合,没有太多科学依据在里头。
虽然并不否认联合用药的方式,甚至认为联合用药是未来治疗肿瘤的可行策略,但是我们并不支持毫无根据的盲目联合。
小的biotech企业是在创业初期有着严重的资源束缚,无论是资金还是时间都不支持我们对所有可能药物组合进行测试,无论是体外测试还是体内测试,都不现实。如果联合用药的背后的分子机制仍没有搞清楚,那么随机组合的筛选策略既不现实也不聪明。相比之下,我们更需要的理性的、聪明的药物联用策略。
接下来,我们就以案例的形式看看什么样的联用策略更有吸引力。
由于科学研究的局限性,药物对于人体的作用机理很难一下子全部搞清楚,即使在临床上使用多年后,药物与人体的新的作用机理仍会源源不断的被科学家发掘出来。Azacitidine(阿扎胞苷-AZA)是一种去甲基化抗肿瘤药物,可影响细胞分化、基因表达和DNA的合成与代谢,从而产生细胞毒性,导致细胞快速的分裂死亡。阿扎胞苷于2004年5月被美国FDA批准,用于治疗MDS(骨髓增生异常综合征)。2012年,有科学家发现并报道了阿扎胞苷可以促进癌细胞过度表达多种蛋白,其中包含一种叫做Calreticulin的蛋白。Calreticulin蛋白是癌细胞表面的一种蛋白,可以向免疫细胞发出“吃我”的信号。
美国公司FORTY SEVEN(NASDAQ:FTSV)很快就抓住了这个机会。FORTY SEVEN的研究成果显示巨噬细胞在人体先天免疫系统中扮演着关键的作用,它们可以识别癌细胞发出的所谓“来吃我”信号并吞噬它们。于是FORTY SEVEN开发了主打产品:CD47抗体,CD47单抗是癌细胞表面的是负向免疫检查点,抑制癌细胞“别吃我”信号。
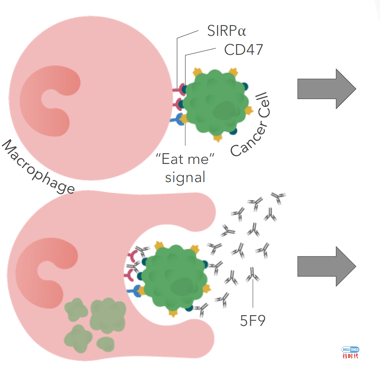
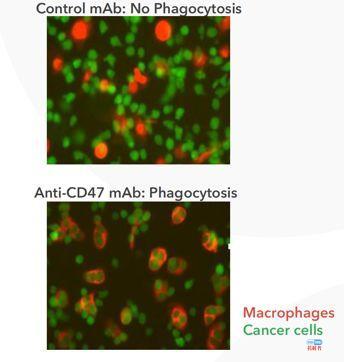
一个刹车,一个油门,CD47抗体(5F9)+阿扎胞苷(AZA)的联用方案应运而生!他们在临床前研究中确认阿扎胞苷可以增加Calreticulin的表达(下图左),发出“来吃我”信号后,立刻决定采用联用策略在动物模型上一探究竟(下图右)。
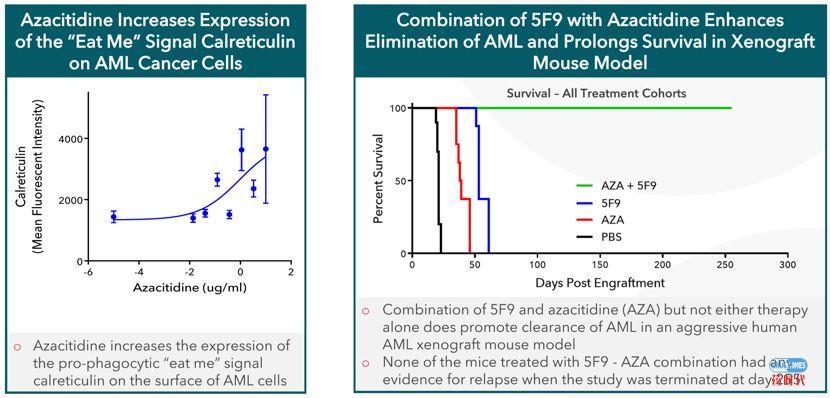
小鼠动物模型显示,无论是CD47抗体还是阿扎胞苷,单药策略都无法大幅度延长小鼠的生存期,但是二者的联用却效果惊人。采用联用策略治疗的小鼠持续给药255天后终止给药后,无一例复发。
动物的药效能否顺利转化到临床上去呢?我们接下来看一看二者联用在临床上的神奇表现:共有25名AML/MDS患者可评估疗效,AML患者的总缓解率为64%;MDS患者的总缓解率为100%。AML患者和MDS患者的完全缓解率/复合完全缓解率分别为50%和55%。令人震惊的是,11名MDS患者中有9名依据IWG标准评估为客观血液学缓解,且三分之二的AML患者摆脱了对输血的依赖。除了血液学缓解之外,在一些患者中还观察到了完全细胞遗传学缓解,可以说被彻底治愈!
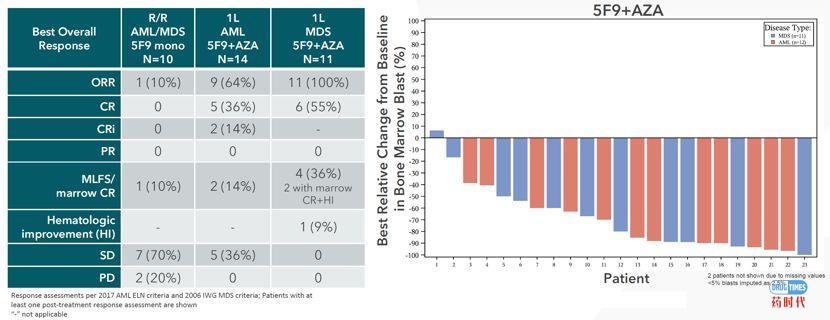
很显然,通过临床前数据和临床数据双重验证,这个联用策略是非常有吸引力的。
这也印证了一个制药前辈跟我讲过得一句话:“别再苦心提炼什么项目的差异化了,项目要是真有差异化,你肯定会感受到的!哪还需要什么提炼!”
上个月辉瑞又土豪了一把,宣布以现金48美元/股价格收购Array生物制药,交易的总企业价值约为114亿美元。笔者开始对Array这个公司还真不怎么熟悉,近期看MAPK通路才逐渐关注上了这家企业,而且越看越喜欢,喜欢它“小聪明”背后的大智慧。
MEK和BRAF是MAPK信号通路(RAS-RAF-MEK-ERK)中的关键蛋白激酶。研究表明,这一通路调节了包括细胞增殖、分化、存活、血管生成在内的多种关键细胞活动。在许多癌症中,如黑色素瘤、结直肠癌和甲状腺癌,这一信号通路中的蛋白质已被证实异常激活。在这个信号通路里面主要有三个玩家,两个带头大哥(罗氏和诺华)和一个小弟(Array)。
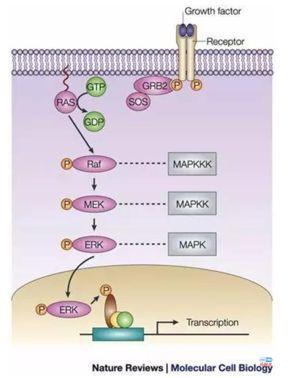
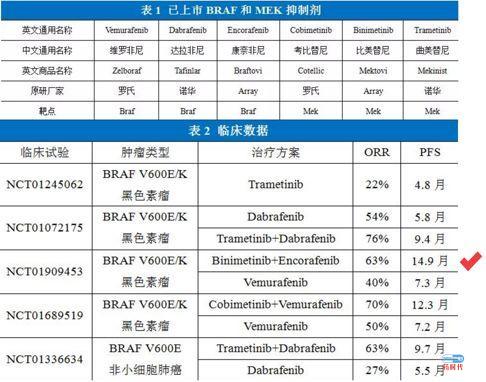
今年6月份,美国FDA批准Array的BRAF+MEK的联用方案,用于经FDA批准的一种检测方法证实存在BRAF V600E或BRAF V600K突变的不可切除性或转移性黑色素瘤患者的治疗。
FDA为什么批?就是上图中的14.9个月啊!史上最佳!别小瞧Array的联用方案比罗氏多出来的这两个多月,能够在巨头的眼皮底下成长、逆袭,也是不容易的。
下面跟大家分享分享Array这次BRAF+MEK联用策略生死之战。
针对BRAFV600E/K突变的黑色素瘤,MAPK通路上第一个获批的是上游靶点BRAF抑制剂是罗氏的Vemurafenib,第二个是诺华的Dabrafenib。但是,临床结果显示,BRAF单药耐药很快产生,MAPK被重新激活。
出了耐药的问题以外,科学家们还发现了一个奇怪的现象,BRAF抑制剂居然是一个“两面派”。一方面对突变型的BRAF起到抑制作用,对肿瘤的生长起到抑制作用。另一方面却可以激活野生型的BRAF,促进二聚作用,进而激活正常组织中的MAPK通路。这会导致严重的毒性作用,比如继发性鳞状细胞皮肤癌和其他皮肤毒性。如此一来,BRAF单药疗法的故事讲不下去了。
很快,带头的两位大哥罗氏和诺华想到了联用策略。他们在MAPK通路上同时靶向BRAF和MEK靶点,改善与BRAF相关的MAPK激活相关的矛盾毒性效应。临床试验证明,相比单药,剂联合用药可提高疗效,罗氏和诺华各自家的BRAF+MEK都获批了。罗氏的联用方案(2015年获批)可以将耐药性时间从7个月延长到12个月。
Array看着两位大哥的一顿神操作,再看看自己尚在试验中的BRAF抑制剂Encorafenib以及MEK抑制剂Binimetinib,压力山大。接下来怎么办呢?是胎死腹中还是放手一搏?
Encorafenib是Array开发的新一代ATP竞争性的BRAF抑制剂,离解半衰期(>30 h)相比罗氏的Vemurafenib和诺华Dabrafenib高十倍以上,理论上对于靶点的抑制作用会更强。而且,并且这个抑制剂对于正长野生型的BRAF的激活作用会相对减弱。如果跟罗氏和诺华拼BRAF单药,Array还是有信心的。但是人家套路变了,玩起了combo。如果Array再死抱着自己的单药继续试验,那未来的PFS也很难超过罗氏的vemurafenib+cobimetinib组合。
Array决定直接采用BRAF+MEK的联用策略。Array在一期临床试验中发现Encorafenib与binimetinib联用后,最大耐受剂量会相比单药进一步提高。因此,Array后续的二期试验采用了比较激进的高剂量策略,一直到三期试验顺利结束。
最终试验结果显示Array的联合用药的PFS比罗氏的组合仅仅多了2.6个月,险胜。
2018年6月,FDA批准encorafenib和binimetinib(联合用于患有BRAF V600E或V600K突变的不可切除或转移性黑素瘤患者,成为第三个被批准的BRAF-MEK抑制剂。
这个故事有点长,但是这是众多biotech企业整天要面临的问题,一边大药企在翻江倒海式的临床申请,一边新技术雨后春笋式的涌现。如何在激烈的竞争中脱颖而出呢?还是要时时刻刻关注自己在赛道中的位置,抓住弯道超车的机会。
大药企喜欢联用,在他们看来这是守住疆土、拓展版图最快的办法!以阿斯利康为例,看到默克的K药(Keytruda)和BMS的O药(Opdivo)在各个疾病领域攻城掠地。同样是制药巨头,天之骄子,阿斯利康眼看在眼里,急在心里。阿斯利康看看左手中已经获批的PDL1度伐单抗(Durvalumab),再看看右手中的CALTA4单抗Tremelimumab、EGRFR抑制剂奥西替尼(Osimertinib)和PARP抑制剂奥拉帕利(Olaparib)等等众多明星分子,可以说是一手好牌!于是阿斯利康一口气开了100多个与自己PDL1得联用方案!
大药企之间的斗争犹如抗战的正面战场,壮观且激烈,弄的众多小药企也跟着激动起来。笔者劝大家醒一醒,大药企的资金、临床、渠道优势都是小公司是无法比拟的,biotech公司跟大pharma学战略,死路一条。好在肿瘤市场足够大,大企业有大企业的玩法,小企业有小企业的活法,各自凭本事吃饭。
我们来看看另一家biotech企业打造的创新平台是如何成功吸引大药企合作开展联用策略的。
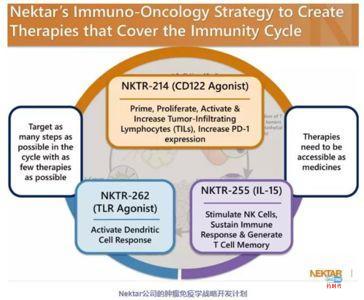
Nektar Therapeutics是总部位于美国旧金山的一家生物制药企业,旨在创造新给药途径的智能药物。他们拥有先进的聚合物药物改造平台,通过仔细选择聚合物的结构、组成和大小,并通过确定连接剂分子的正确位置和化学成分,来塑造聚合物药物偶联物的行为。聚合物组分在不影响靶受体生物学行为的前提下,影响复合分子的PK、生物分布和选择性。Nektar开发的技术平台具有以下功能:
在2018年的ASCO年会上,Nektar发布了一个万众瞩目的革命性明星抗癌药NKTR-214。其和PD-1抑制剂联用,可大幅度提高PD-1抑制剂的有效率,甚至连PD-L1阴性也有效,给无数癌症患者带来希望
。
NKTR-214并不神秘,它源于一个20多年前就被使用的抗癌药——白细胞介素2(简称IL-2)。IL-2是最早的免疫治疗药物。不过,由于临床使用的剂量很高,IL-2的副作用很大,比如严重的低血压和血管渗漏综合征。
另外,白介素-2是一种可以刺激CD8+T细胞和NK细胞增殖的细胞生长因子,当活化的CD8+T细胞或者NK细胞进入肿瘤后会发送白介素-2召集更多的免疫细胞攻击肿瘤。然而事情并没有那么简单,白介素-2除了可以刺激杀伤性的免疫细胞增殖还可以刺激调节性T 细胞增殖,进而抑制免疫反应,中和抗肿瘤免疫效应,癌细胞趁机钻了这个空子,疯狂生长。
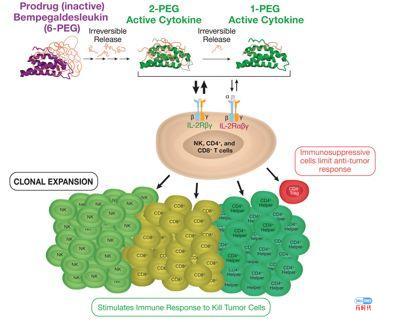
那有没有办法只刺激CD8+T细胞和NK细胞增殖而不刺激调节性T细胞增殖呢?有!NKTR-214就通过技术平台成功实现了这个功能。
Nektar先将IL-2分子上添加6个聚乙二醇(简称PEG)修饰,形成了无活性的药物(下图左侧紫色);给肿瘤患者注射之后,这6个PEG修饰会逐渐脱落,形成了有活性的2-PEG和1-PEG的形式(下图右边两个绿色),2-PEG 形式的IL-2可以与CD8+T细胞和NK细胞表面的受体结合,刺激免疫细胞的增殖,1-PEG的形式IL-2并不与调节性T细胞增殖受体结合,从而不增加调节性T细胞增殖。
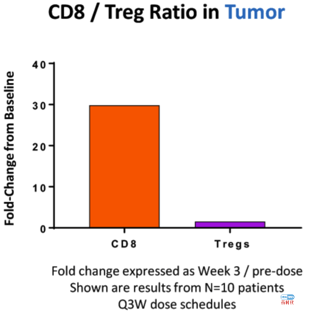
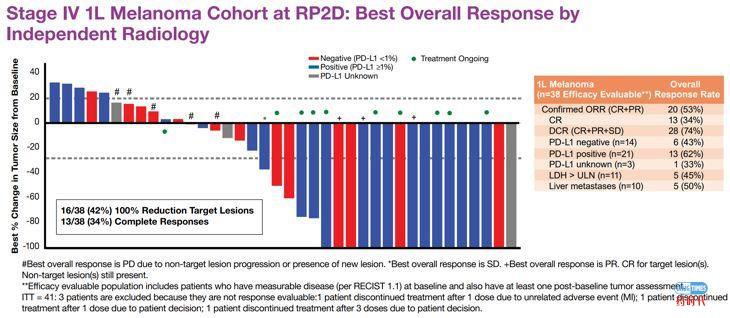
Nektar 的NKTR-214与BMS的纳武单抗在后续展开了一系列的联用试验。以黑色素瘤为例,在Ib队列拓展试验中即观察到了非常亮眼的药效:ORR 53%, CR 34%, DCR 74%。
Nektar在2018年初出席了在美国旧金山举行的第36届JP Morgan 医疗大会,公布了多项极具潜力的药物研发进展以及未来的联用策略。一个月内,该公司的股价以惊人的增长速度飙升了40%!

打铁还需自身硬,不要指望别人的分子化你的“腐朽”为神奇,而要争取做到你的分子能够为其他分子“画龙点睛”。联用对于biotech来说,是“锦上添花”而非“雪中送炭”。只有本身效果优异的分子与其他分子组合的时候,才能提高临床的成功率。
以上就是我们以案例的形式跟大家分享的我们比较认可的联用策略。
临渊羡鱼,不如退而结网。
最后谈谈我们对于药物combo项目的基本要求:
第一, 要有入组或者PD的biomarker。好的联用策略都有一个共性,那就是biomarker,只有这样才能提高临床成功率,同时也会让临床入组人群更精准。(写这篇文章的时候李进教授关于biomarker重要性的讲话还没有发出,能和临床大咖一致看法感到很荣幸)
第二, 要有相对科学的动物模型。这是个难点,尤其是和肿瘤免疫相关药物的联用。尽管最近几年动物模型的质量不断提高,但是肿瘤免疫相关的模型的临床转化率相比其他模型仍然较低。我们知道小鼠的荷瘤模型是重度免疫缺陷的,如果做肿瘤免疫相关的combo,药物作用于免疫系统而非肿瘤本身,那么动物药效模型就很难模拟。如何设计出好的动物模型,这是新药科学家联合CRO要告诉我们的答案;
第三, 要知道临床试验怎么做。对于还没有IND的项目就聊临床是不是过早?一点都不早,我们甚至要求在项目立项的时候就要求说明临床试验方案的设计。临床试验设计会直接影响药物联用策略成功与否,上面讲的Array的BRAF+MEK就是一个实例。药物定位几线疗法、入组什么样的患者,如何设计剂量爬坡,联用剂量如何确定,跟谁做对头等等,这才是考量创始人对联用理解深度的关键点。
第四, 要有临床前的联用药效数据。我们姑且不提1+1大于2的事儿,但是我们期望看到足够的差异化。究竟多大的差异算差异?上面案例的哪些就是很好的参考标准。如果差异化不足,那要像Array那样在临床策略上冒死突围了。

以上文字由Biotech venture capital原创,仅为促进讨论与交流,不构成法律意见或咨询建议。版权所有,违者必究。如需转载,请注明作者和Biotech venture capital原创。
参考:
1. Pradipta Das et al. “A Survey of the Structures of US FDA Approved Combination Drugs”J. Med. Chem.2019, 62, 4265−4311
2. J. Tang, A. Shalabi et al.“Comprehensive analysis of the clinical immuno-oncology landscape”Annals of Oncology29: 84–91, 2018
3. Francesca Buchi et al.“Proteomic analysis identifies differentially expressed proteins in AML1/ETO acute myeloid leukemia cells treated with DNMT inhibitors azacitidine and decitabine”Leukemia Research 36 (2012) 607– 618
4. https://ir.fortyseveninc.com/static-files/6db56867-a8b2-4e98-9d6d-c42983280293
5. Reinhard Dummer et al. “Encorafenib plus binimetinib versus vemurafenib or encorafenib in patients with BRAF-mutant melanoma (COLUMBUS): a multicentre, open-label, randomisedphase 3 trial”www.thelancet.com/oncology Published online March 21, 2018 http://dx.doi.org/10.1016/S1470-2045(18)30142-61
6.https://www.nektar.com/application/files/9015/5941/6417/Hurwitz_et_al_ASCO_2019_MEL_6.1.19.pdf
过往文章:
发布者:药时代,转载请首先联系contact@drugtimes.cn获得授权

 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
