
⬆️ 欢迎参加2020中国NASH大会!
2020年8月20日是诺贝尔医学和生理学奖获奖者德国科学家保罗•埃尔利希(Paul Ehrlich)博士逝世105周年的日子(1854.03.14 –1915.08.20)。Ehrlich博士除了最为人所知的在免疫学理论和血清疗法方面的研究工作外,他还是“血脑屏障”现象首位发现者。1895年Ehrlich博士发现外周注射染料后,脑部并不能被染色,虽然Ehrlich博士当时并未对该现象给出准确的解释,但他的这一发现直接开启了后续对血脑屏障(Brain-blood barrier,BBB)的深入研究。

我们现在都知道血脑屏障指的是脑毛细血管壁与神经胶质细胞形成的血液与脑组织之间的屏障。鉴于BBB与药物是否能入脑直接相关,因此对于BBB的研究包括其结构、功能以及如何克服BBB等方面在学术界与制药界(尤其是开发中枢神经系统(Central nervous system,CNS)药物公司)都有着广泛而深入的研究。
药物代谢及药代动力学(Drug metabolism & pharmacokinetics,DMPK)是研究药物分子在生物体内吸收、分布、代谢和排泄(Absorption, Distribution, Metabolism & Elimination,ADME)的学科,在药物早期筛选以及后期临床开发阶段都有着重要的作用。因此,笔者想以BBB为切入点,介绍一下DMPK在CNS药物开发中的作用,希望能给CNS药物的从业者们一些提示。
想在开篇就声明一下,本文内容中有很多都是笔者根据个人经验的一些判断,难免会有一些主观偏向和疏漏,非常希望读者朋友们能指出文中漏洞,也希望能跟大家有深入的交流和探讨,欢迎留言。
1. 中枢类疾病/药物简介
中枢神经系统疾病是指影响大脑(Brain)或脊髓(Spiral cord)结构或功能的一组神经障碍,主要包括神经退行性疾病、功能性紊乱、结构性障碍、中枢神经系统感染和脱髓鞘疾病。提到中枢类疾病,其实每个人都能说上几个,最为人所知的有老年痴呆症(又叫阿尔茨海默症(Alzheimer’s disease,AD))、帕金森症(Parkinson’s disease,PD)、抑郁(Depression)、精神分裂症(Schizophrenia)、癫痫(Epilepsy)、中风(又叫脑卒中,Stroke),还有在肿瘤领域经常能听到的原发性脑瘤和脑转移(Brain metastasis)等。
从更精确的分类上来说,约翰霍普金斯研究所将中枢神经系统的受损划分为以下几种情况:
-
感染:如脑膜炎、脑炎、脊髓灰质炎和硬膜外脓肿;
-
血管疾病:如中风、短暂性脑缺血发作(TIA)、蛛网膜下腔出血、硬膜下出血和血肿、以及硬膜外出血;
-
结构性疾病:如脑或脊髓损伤、贝尔麻痹、颈椎病、腕管综合征、脑或脊髓肿瘤、周围神经病和格林-巴利综合征;
-
功能障碍:如头痛、癫痫、失眠、神经痛、焦虑、抑郁症;
-
退化症:如帕金森病、多发性硬化症(Multiple sclerosis,MS)、肌萎缩侧索硬化症(Amyotrophiclateral sclerosis, ALS)、亨廷顿舞蹈病(Huntington’s disease, HD)、阿尔茨海默病;
-
肿瘤:如脑部肿瘤、脑癌等。
再说说中枢神经系统药物(CNS drugs),通常指的是治疗功能障碍或神经退化症的药品。这些损伤涉及到神经系统病源性破坏,往往难以治愈,患者必须长期服药,但随着基因以及细胞疗法的兴起,对于诸如帕金森病、ALS以及HD等疾病能实现单次或者长时间间隔给药而达到临床治愈的可能[1-3]。
2. CNS药物研发现状
3. 血脑屏障介绍
如前言所述,1895年Ehrlich博士在研究染料时意外发现了“血脑屏障”现象,他与其学生埃德温·戈德曼(Edwin Goldmann)将蓝色染料通过静脉注入动物体内后发现,除了大脑外几乎所有器官都变成了蓝色。随后,Lewandowski于1900年也观察到了类似的现象,并首次提出了“血脑屏障(德语“Blut-hirn-schranke”)”这一概念。1913年,Edwin Goldmann为了进一步验证该屏障的存在,鞘内注射染料后发现仅大脑能被染色,而外周组织则不能。
综上,经过近20年的研究,对于脑部和外周组织间存在血脑屏障这一事实基本上得到广泛认可,但当时还没人知道形成该屏障的原因,直到上世纪60年代电子显微镜的出现,科学家能够直接观察到所谓的血脑屏障。下面列举了血脑屏障发现史上的一些里程碑事件:
• 首次发现外周静脉注射药物后药物分子无法到达大脑 (Ehrlich 1885)
• 首次提出“血脑屏”障这一概念 (Lewandowski 1900)
• 鞘内注射药物后药物分子能到达大脑,拓展了最初的“血脑屏障”概念,并首次提出“脑脊液”假说,即鞘内给药后药物分子是通过脑脊液进入大脑的 (Goldman 1913)
• 首次发现在脑部疾病中显示出“血脑屏障缺陷”,即在颈动脉内施用高渗溶液后表现出短暂的血脑屏障打开或破坏(Broman 1941)
• 电子显微镜研究表明,皮层中存在细胞外液 (vanHarreveld 1966)
• 发现脑血管内皮细胞之间的“紧密连接(tight junction,TJ)”在血脑屏障中的重要作用 (Reese and Karnovsky 1967)
• 采用放射性同位素标记物首次发现己糖、氨基酸和胺等能透过血脑屏障 (Oldendorf 1971)
• 血脑屏障的分子生物学研究:葡萄糖转运蛋白基因的克隆与测序 (Weiler-Guttler et al 1989)
血脑屏障(Blood-brain barrier,BBB)指脑毛细血管壁与神经胶质细胞形成的血液与脑组织之间的屏障,其主要由血管内皮细胞(Endothelial cells)(细胞之间通过紧密连接(Tight junctions,TJ)和黏着连接(Adherent junctions,AJ)相互联系)、星形胶质细胞(Astrocytes)、周细胞(Pericytes)、细胞外连续的基底膜和细胞外基质及神经元构成,也包括一些免疫细胞等(见图1)。
血脑屏障能防止毒素及其他外源有害物质例如药物分子进入脑内损害神经细胞,同时又能保证对维持脑功能所需物质的摄入和药物代谢产物的排出,使内环境相对稳定,以维持神经细胞的正常功能。
药物分子进入脑实质主要通过以下途径:1)被动扩散(Passive diffusion),大部分小分子化合物都是通过这一途径透过BBB从而实现入脑,其可能受主动外排(Efflux)的限制;2)通过细胞间隙入脑,该方式通常只能对一些极性低分子量的化合物适用;3)由脑内皮细胞表达的转运蛋白(Transporter)介导的摄取;4)由脑内皮细胞表达的受体蛋白(Receptor)介导的转运。对于转运蛋白以及受体介导的转运,本文会在4.1.6节做进一步介绍。
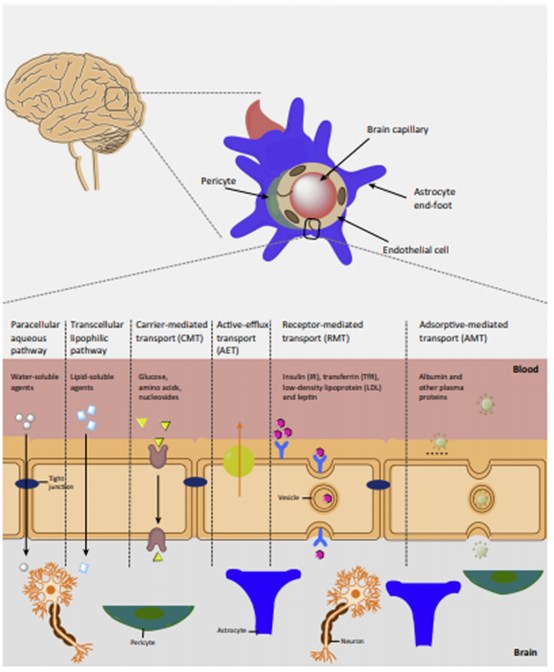
图1 血脑屏障结构及药物分子进入脑的主要途径[4]
BBB实现其阻止外来有害物质进入脑实质的另一个重要因素是BBB相关外排转运体的参与。图2列举了BBB上的常见的药物转运相关的转运体,其中有我们熟知的外排转运体P-gp、BCRP和MRP家族以及在肝脏也高表达的摄入转运体OATP家族。
除了限制外源物质入脑,即我们通常所说的药物或毒物,BBB上也大量表达另一类摄入转运体来维持营养物质平衡,如Glut1、LAT1和ENT1,分别是葡萄糖转运蛋白1(Glucose transporter 1,Glut1),主要负责葡萄糖跨膜运输、L-型氨基酸转运载蛋白1(Large neutral amino acid transporter 1,LAT1),主要负责转运大的、中性氨基酸、平衡型核苷转运蛋白1(Equilibrative nucleoside transporter 1,ENT1),主要负责核苷酸的转运。
对于此类摄入转运体,理论上是可以作为药物靶点开发的,思路大概是先鉴别出仅在BBB高表达的转运体,然后针对其设计小分子化合物或者抗体药物来治疗脑部疾病,既能实现增加脑部药物暴露量,又能降低外周毒副作用。
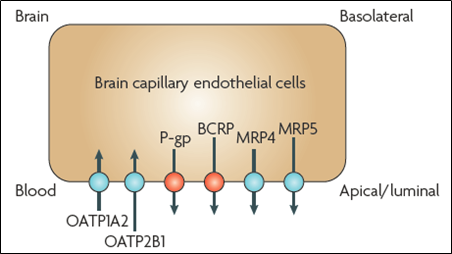
图2 BBB上主要药物相关转运体[5]
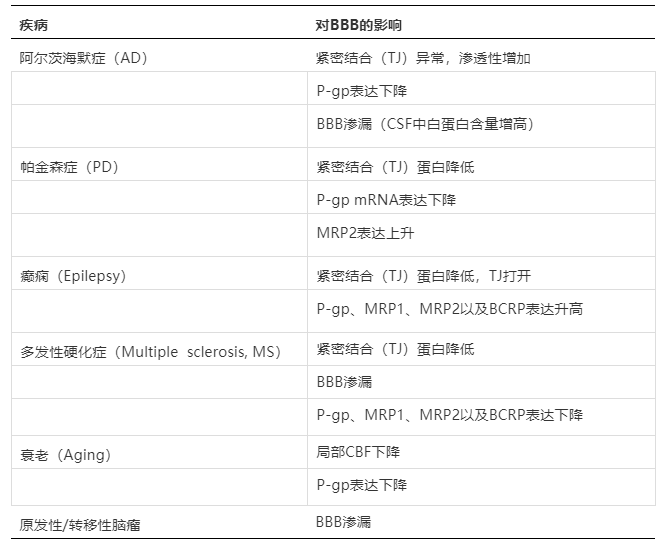
在介绍血脑屏障里程碑事件的时候已经提到了疾病状态对BBB会产生影响,即在颈动脉内施用高渗溶液后表现出短暂的血脑屏障打开或破坏。下表总结了常见CNS疾病对于BBB的影响:
在新药研发中选择合适的动物模型对于药物评价有着至关重要的作用,因此从转化(Translational science)的角度去分析种属差异就显得十分必要了。举个例子,在筛选入脑化合物的时候,大鼠SOA(Short oral absorption)实验是最常用到的动物模型,通过比较化合物在大脑与血液的浓度比值来判断其入脑程度。如果化合物的被动扩散较好,例如Papp > 5*10-6 cm/s,也并非人P-gp底物,但在该模型中并未发现在大鼠中有足够的脑部暴露,很可能的原因是该化合物是大鼠P-gp底物,尽管P-gp在人和大鼠的同源性非常高[10]。
4. CNS药物研发中的DMPK评价
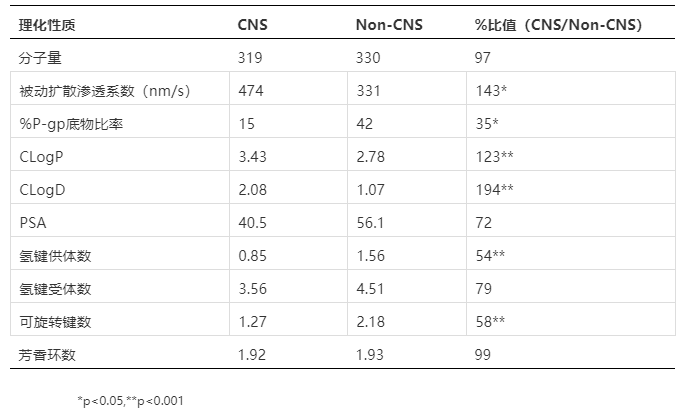
根据BBB的生理结构,我们其实比较容易推出入脑小分子化合物的一些基本理化性质要求,比如亲脂性高、分子量不能太大、电负性低等,这些特性都是为了保证药物分子能较为容易地自由透过BBB。Mahar Doan[11]总结了48个CNS和45个非CNS(non-CNS)小分子化合物的理化性质方面的区别(表2、3),可以看到脂溶性(CLogP和CLogD)、氢键供体数(hydrogen bond donor)以及可旋转键数(rotatable bond)上两类化合物有显著性区别,脂溶性方面CNS药物对比非CNS类更高。同时,与理论相符的是CNS药物的渗透性(Papp)更高,是P-gp底物的概率也更低。
BBB的生理结构导致其致密度较高而渗透性较差,因此要求化合物的渗透性或者说透膜性更强。评价药物分子透膜性我们经常用到的体外模型有Caco-2单细胞层模型、MDCK-WT以及MDCK-MDR1模型,Papp(Apparent permeability)是具体的评价参数。
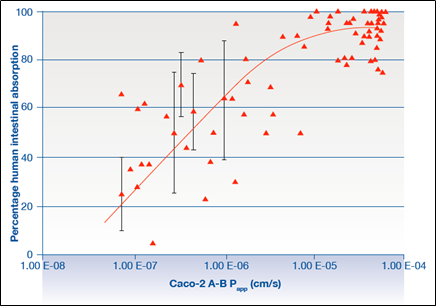
对于口服药物,要求其能够穿过肠细胞膜后到达全身血液系统,图3表明Papp大于1*10-6 cm/s就能使得60%以上的药物被吸收,超过10*10-6 cm/s的话80%以上的药物分子能被吸收。
我们都知道,在BBB上高表达的P-gp和BCRP等外排转运体是导致很多药物分子,例如化疗药,无法穿过BBB进入大脑的原因,因此,在早期药物筛选中需要剔除掉这类外排转运体底物的化合物分子。目前临床前对于外排转运体主要是评价P-gp和BCRP,其细胞模型主要为MDCK-MDR1和MDCK-BCRP。
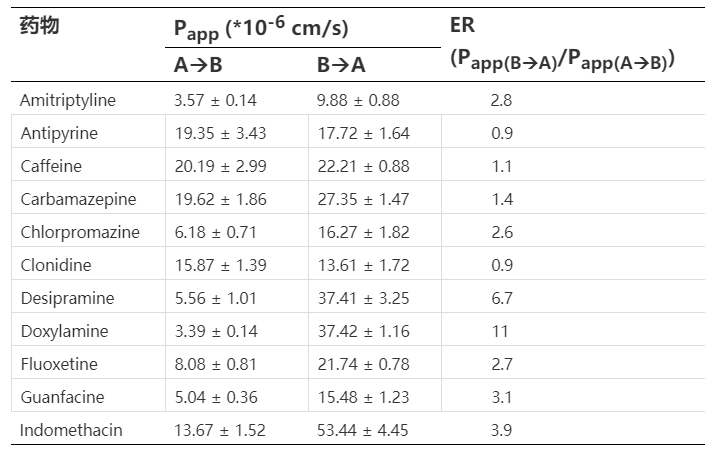
评价药物分子是否为外排转运体的底物,通常会用外排率(Efflux ratio,ER)来评价。ER的具体实验测量本文不再赘述,大家可以参考以下网址(https://www.cyprotex.com/admepk/in-vitro-permeability/p-gp-substrate-identification,https://www.cyprotex.com/admepk/in-vitro-permeability/bcrp-substrate-identification)。
以P-gp为例,如果ER高于2说明化合物是该转运体的底物(但正如表3所示,一些药物分子体外实验测得的ER高于2,但并不是P-gp的底物,也能入脑,究其原因可能是体外细胞模型还不能完全反映体内),其中对于CNS项目来说,要求其P-gp的ER小于2,即化合物不能是P-gp的底物,但对于BCRP而言,一般来说由于其在BBB上的外排作用相较于P-gp更弱,因此ER可以放宽至小于5。
此外,由于P-gp和BCRP在BBB上是共表达的,都参与到药物分子的外排,因此MDCK-P-gp/BCRP双表达模型也被很多公司采用,能同时将两个外排转运体的作用一起体现出来[13]。
关于摄入转运体,前面也提到过在肝细胞中大量表达的OATP家族也在BBB上有表达,特别是OATP1A2,研究发现其在脑部的表达量甚至高于肝脏[14],因此能够帮助一些药物分子入脑[15]。
但目前,专门针对于这类转运体(并非营养或者内源性物质转运体)开发的入脑药物就笔者了解是没有的,原因在于:1)总体来说,脑部OATP家族的表达量相对于肝脏还是很少的,这点直接决定了药物入脑的量不会太高;2)因为是OATP的底物,该类药物的肝脏清除可能会比较大,也会相应地减少药物入脑的总量;3)从药物分子设计的角度来看也很难设计这样的分子专门针对此类转运体。例如抗血脂他汀类药物绝大部分都是OATP底物,其入脑能力取决于本身理化性质与转运体摄入,Lovastatin和Simvastatin已在临床证明其可以入脑,但Pravastatin和rosuvastatin在临床上却并没有发现有明显的入脑能力[16]。
从化学家那里拿到一个化合物分子后,从DMPK角度来说一般会先评价其理化性质,如溶解度、LogP等,如果没有明显缺陷的话下一步会对其渗透性和是否是P-gp底物进行评价(一般来说这两个实验是一起做的,MDCK-WT vs MDCK-MDR1),如果其Papp能达到5*10-6 cm/s以上,又不是P-gp底物,体外代谢稳定性也还不错,那接下来会安排体内PK评估。相对于只采集血浆的常规PK,为了能评估脑内药物暴露量,大鼠SOA实验通常会被使用,即在每个采血时间点采集动物的肝门静脉血、外周循环血以及大脑,目的是既可以评估常规PK,又可以得到肝提取率(Hepatic extraction,Eh,即1减去外周循环血与肝门静脉药物AUC比值)以及监测脑部药物浓度,判断药物分子是否能入脑。
在3.4节已经提到了Kp,uu这个概念,一般而言这个参数就是通过SOA实验计算出Kp,再乘以fu,brain与fu,blood比值得到的,比如该参数如果为0.5,说明血管中一半的游离药物能进入穿过BBB进入大脑。对于不同公司来说,CNS项目中对Kp,uu的要求可能不尽相同,笔者了解到的采用0.5和0.3作为阈值的都有,但一般最后得到的PCC(Preclinical candidate)化合物其都在0.5以上。
注:1)Kp,uu概念的提出是基于“游离药物理论”,即只有游离的药物才能发挥药理作用。2)fu,brain的计算方式有多种,例如常规的组织匀浆测定以及更为精确的脑微透析(Microdialysis)。
中枢神经系统肿瘤,例如原发性胶质母细胞瘤以及肿瘤脑转移等,在中国乃至全世界范围内都存在巨大的未满足临床需求,急需有效的治疗方法。脑部肿瘤药物开发的主要挑战之一是大多数药物难以透过血脑屏障。脑转移是指原发于身体其他部位的肿瘤转移至脑部,是临床上最常见的CNS恶性肿瘤之一,具有显著的发病率和死亡率,其发病率约为原发性脑部肿瘤的10倍。
据统计,约10%的恶性肿瘤确诊患者在进展过程中会发生脑转移,不同原发性肿瘤发生脑转移的几率具有显著差异,最常见易发脑转移的原发肿瘤为肺癌、乳腺癌和黑色素瘤。下文会就治疗脑转移药物的开发举两个典型的例子,即阿斯利康公司开发的奥西替尼和AZD3759。
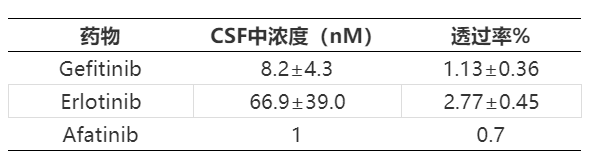
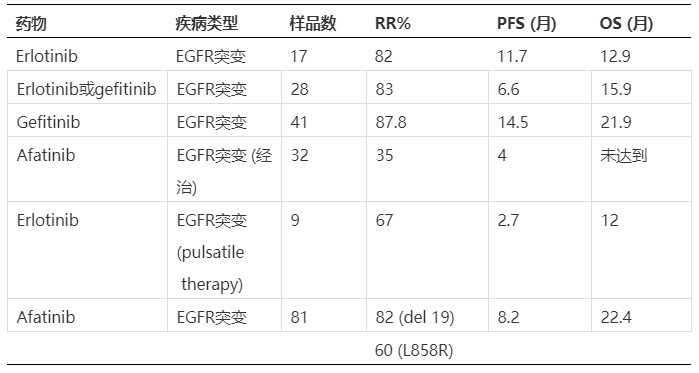
奥希替尼(Osimertinib,AZD9291)作为第三代EGFR抑制剂,能克服第一代出现的T790M耐药,目前已经广泛用于一线以及二线EGFR突变的非小细胞肺癌治疗,其在脑转移病人上也取得了良好的效果。表4总结了不同EGFR抑制剂在小鼠SOA模型上的入脑情况[17],可以看到相对于一代吉非替尼(Gefitinib)、二代阿法替尼(Afatinib)和三代Rociletinib(CO-1686),奥西替尼表现出更为出色的入脑能力,其最高浓度(Cmax)下的Kp可以达到3.41(当然最后需要经过fu的校正得到Kpuu),为吉非替尼十数倍。

4.1.6.1.2 AZD3759
2016年AZ中国研发中心在SCIENCE TRANSLATIONAL MEDICINE杂志上介绍了其入脑EGFR抑制剂,AZD3759,用以治疗EGFR突变的非小细胞肺癌脑转移[19]。AZD3759理论上应该划归为一代EGFR抑制剂,因为其对T790M突变无效。作为入脑化合物,AZD3759有较高的渗透性,其Papp值达到29.5*10-6 cm/s,也不是P-gp和BCRP的底物,因此能很好地透过BBB进入脑内发挥作用。
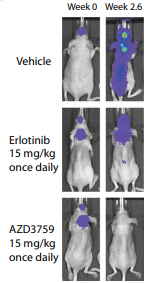
与第一代EGFR抑制剂厄洛替尼相比的话,AZD3759在临床前小鼠模型上显示出更为出色的入脑能力,其Kpuu,brain达到0.6以上(表7),也直接带来更好的脑内肿瘤的控制能力(图4)。

除了开发能直接透过BBB化合物分子外,研究人员也希望通过脑血管内皮细胞表面的转运体/受体介导药物转运来提高脑组织中药物浓度。研究发现,在脑血管内皮细胞上存在多种转运体和受体,如LAT1、转铁蛋白受体(TfR)和胰岛素受体等。
之前,基于提高BBB渗透率的药物开发策略其效果并不理想,因此使用血脑屏障内源转运系统看似是一种合理的手段,这种方法可以用来调控药物的转运,且不破坏血脑屏障完整性。
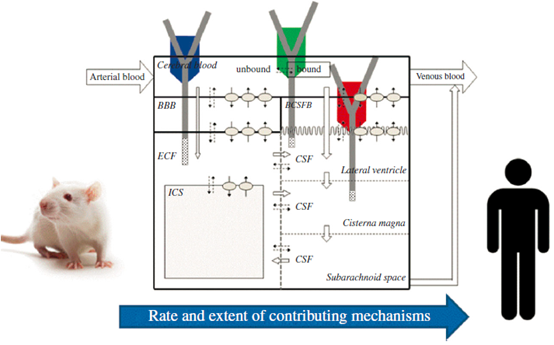
依照类型,内源性血脑屏障转运系统可分为:载体转运(Carrier-mediated transport,CMT)、主动运输(Active efflux transport,AET)和受体介导转运(Receptor-mediated transport,RMT)(图1)。
载体转运体和主动运输体系统,负责血液和脑组织之间小分子运输,如葡萄糖、氨基酸、脂肪酸、核苷等。受体介导转运体系统,负责特定内源性大分子的跨血脑屏障转运,如胰岛素、转铁蛋白、低密度脂蛋白、胰岛素样生长因子、瘦素等。
血液系统中的分子可以与BBB表面特定受体结合,结合后,通过受体介导作用,复合体分子穿过血管内皮细胞进入大脑。需要强调的是,转运蛋白介导的胞吞作用是底物选择性的,因为只有那些结构与内源性载体底物最为相近的药物才会被吸收并转运到大脑中。
受体介导的胞吞作用被认为是针对脑靶向药物递送的最成熟的策略之一,具有高特异性、选择性和亲和力的特点,尽管配体可能对体内稳态产生影响,而天然配体可能与药物配体竞争降低靶向效率。
LAT1是溶质转运蛋白(Solute carrier,SLC)超家族成员,通常高表达于BBB,参与氨基酸的转运。此外,研究也发现该转运体在大多数侵袭性恶性肿瘤中也有极高的表达,例如多形性胶质母细胞瘤(glioblastoma multiforme, GBM)、乳腺癌、肺癌和黑色素瘤等[21]。
上个月南通本草八达医药科技有限公司,一家专注于开发靶向SLC药物的新创公司,宣布其自主研发的新药NBQ72S治疗晚期恶性肿瘤的一期临床试验完成首例患者给药(https://www.prnasia.com/story/286174-1.shtml)。
NBQ72S是一款靶向人LAT1的新型小分子药物,经由LAT1转运高效、主动地透过血脑屏障转运至大脑,并选择性地进入LAT1高表达的肿瘤细胞,同时也使得通常不表达LAT1的正常组织免受损伤。
在肿瘤细胞内,NBQ72S通过干扰快速分裂的肿瘤细胞的DNA复制发挥其细胞杀伤活性,从而杀死肿瘤。此外,因为LAT1在大多数肿瘤细胞中也大量表达,所以理论上LAT1靶向药在系统性以及脑部相关肿瘤的治疗中都会有疗效。
4.1.6.4 转铁蛋白受体1(TfR1)
关于转铁蛋白受体的研究较多,其功能是参与铁的转运。
从机制上来说,结合了铁的运转蛋白(Fe-Tf)与血管内皮细胞表面的TfR结合,然后Fe-Tf-TfR复合物经过细胞的内吞作用形成内吞体,内吞体在内皮细胞内pH值降至5.5左右时释放出所结合的铁,在酸性pH下失去铁的转铁蛋自(apo-Tf)仍与TfR结合并一起返回到细胞表面,在生理pH值环境下apo-Tf与TfR分离,apo-Tf回到循环系统再结合铁,从而完成向脑组织运送铁的循环[22]。
同时,跟LAT1类似,由于铁的需求增加,癌细胞例如GBM细胞也表达高水平的TfR1,因此TfR1已被证明是治疗癌症的潜在靶标。
艾伯维德国研发中心主管Alfred Hahn博士说到“仅仅低于5%的小分子药物可以穿透血脑屏障,生物药物几乎不可能穿透血脑屏障”。
相对于小分子化合物,像单抗这类分子量巨大的药物是无法直接穿过BBB到达脑部的,因此,对于CNS抗体类药物的开发,其主要策略是:1)间接发挥疗效,例如在抗体在多发性硬化症(MS)上的治疗一般都是通过抑制外周免疫反应而实现的;2)通过表达在BBB上的受体内吞,设计双靶点抗体(Bi-specific antibody),即一段靶向BBB上的转运蛋白或受体,另一端靶向疾病靶点。
例如,罗氏使用的“Brain Shuttle”技术,通过触发RMT过程将分子运输到大脑中,例如靶向TfR。加拿大的Angiochem公司开发的一种抗体药物ANG4043,能够成功穿过患者的血脑屏障杀死癌细胞,被设计用于治疗乳腺癌。研究人员在临床前研究中发现,这种抗体能够结合低密度脂蛋白相关受体1(Low-density lipoprotein receptor-relatedprotein-1,LRP-1),从而穿过血脑屏障。
最近单抗药物在AD治疗上有巨大的突破,即anti-aβ抗体aducanumab被FDA授予优先上市申请,尽管对其疗效还存在较大的争议。据报道,aducanumab区别于其他临床失败的anti-aβ抗体在于其天然就能够跨越血脑屏障进入脑实质[23],但具体原因还未知,可能也是RMT介导,也有可能是高浓度的抗体药物能直接破坏BBB的完整性[24]。
总体而言,相对小分子化合物,DMPK在单抗药物筛选和开发中发挥的作用有限,因此本文不赘述,感兴趣的话可以参考这篇文献[4]。
目前对CNS药物是有着巨大临床需求的,但困难是CNS药物研发挑战性很大,其中一个需要解决的问题就是如何找到一种方法能在临床前对CNS药物的作用进行准确预测。
目前来说我们对于精确预测CNS药物作用的认识还存在很多空白,也缺乏对脑部药物分布的充分了解。
但随着计算科学的不断发展,对于药物入脑能力的预测,或者说Kpuu的预测目前已经有一些方法了,包括:1)QSAR模型,即将Kpuu与药物的理化性质如分子量、LogP、PSA以及药物特性如Papp、PPB等联系起来;2)基于生理学的药代动力学(Physiological-based pharmacokinetic,PBPK)法;3)PK/PD法。鉴于在制药工业更为广泛的应用,本文将重点介绍一些PBPK和PK/PD法。
先简单介绍一下什么是PBPK。PBPK通过整合人体生理系统参数、药物理化性质和机制性药代动力学数据以提早预测人体内的药物药代动力学特征。荷兰莱顿大学(Leiden University)的Elizabeth C.M. de Lange教授在运用PBPK模型预测CNS药物脑部暴露量方面有着非常深入的研究,因此,本小结将主要以de Lange教授实验室的工作来对PBPK模型预测药物脑部暴露量进行介绍。
如图5所示,类似于其他PBPK预测的过程,需要先在临床前动物模型上对药物在生物体内的PK过程进行验证,然后再转化到人。为了更精确地得到脑部游离药物浓度,在实验操作中采用了微透析(Microdialysis)法。鉴于在临床实际中一般无法直接对脑部药物浓度进行测量,但可以对药物在脑脊液(Cerebrospinal fluid,CSF)中进行实时监测,因此,可以建立“脑-脑脊液”药物浓度关系来预测脑部浓度。
在该PBPK模型中,将脑部划分为侧脑室(lateral ventricle)、小脑延髓池(cisterna magna)以及蛛网膜下腔(subarachnoidal space),通过测量不同区域的CSF与脑细胞间液(brain extracellular fluid,brainECF)的药物交换,最后在大鼠上建立起根据CSF药物浓度来预测脑部药物浓度的PBPK模型,然后转化到人,即在临床上通过测量CSF中的药物浓度来预估脑部药物浓度。
相比较于传统的由最低药物浓度(Cmin)或AUC驱动的药效(Pharmacodynamics,PD)来说,CNS疾病因其机理的复杂性往往无法直接得到明确的暴露量-药效关系(Exposure-efficacy relationship,E-R),特别是对于离子通道等靶点。对于此种情况,受体占有率(Receptor occupancy,RO)理论往往能得到较好的应用。
例如,强生公司开发的右旋氯胺酮(S-ketamine)用以治疗重度抑郁症(Major depression disease,MDD),其可能的靶标为NMDA受体(N-methyl-D-aspartate receptor),是离子型谷氨酸受体的一个亚型。S-ketamine作为一种新型抗抑郁药物区别于传统药物如选择性5-羟色胺再摄取抑制剂(Selective Serotonin ReuptakeInhibitors,SSRI)的地方在于其具有快速起效以及长时间有效这两个特征上。
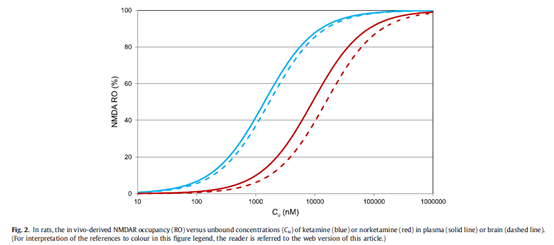
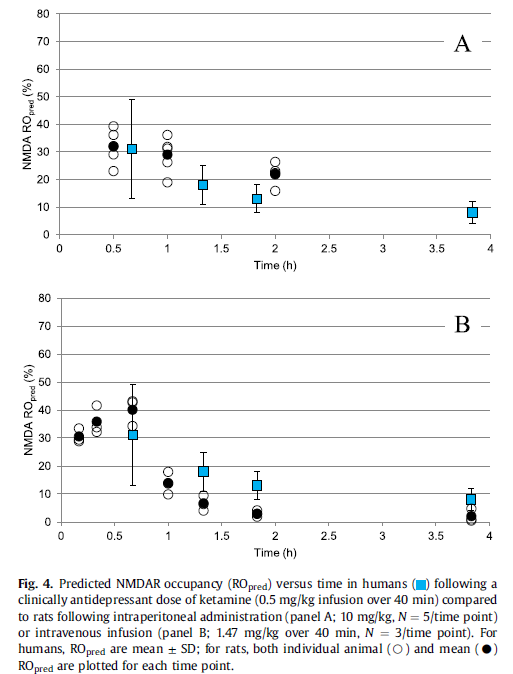
作为双重门控通道,NMDA受体的调控很难通过传统的Cmin或是AUC模型来解释。为此,研究者们采用了受体占有率机制来解释该药的起效机制[25],首先在大鼠模型上构建了RO与药物浓度(包括血液和脑部)的关系,如图6所示。然后根据该模型推导出临床剂量下Ketamine在脑部的NMDA受体占有率,结果表明临床剂量下的最大RO值为30%(图7),提示Ketamine对于NMDA受体只需要达到较低水平的调控即可发挥疗效。
5.展望
为使更多的药物能进人脑组织,发挥更好的疗效,研究人员采取了多种方法来增加药物对BBB的通透性。用于临床治疗的第一个方法是BBB破坏法(blood-brain barrier disruption,BBBD),即颈内动脉注射高渗糖溶液,通过渗透作用吸出脑血管内皮细胞中的水分使其收缩,从而使TJ开放,BBB通透性增加。但BBBD具有侵袭性,即使在周围血循环中无毒的白蛋白进入脑组织后也会引起严重的后果,也因其副作用大而逐渐退出了大众视野。
受体和载体介导药物转运的优点是其能采取灵活的治疗方案,但由于受到治疗药物能否与受体和载体特异性结合,以及受体和载体的数量及转运能力的限制,目前仅有很少一部分治疗药物可通过这一方法转运到脑组织,但该领域的研究也还是受到了广泛关注。
另外需要特别强调的是,对于CNS疾病的治疗,我们不能把思路局限在药物分子一定要透过BBB才能发挥药效这个假设上,实际上,就如前文提到的很多大分子抗体药物其实是作用于外周靶标从而间接治疗脑部疾病的,再举一个目前CNS领域可以说是讨论得最为火热的例子,即绿谷制药的抗AD药物“GV-971”,一种来源于海藻的寡糖类药物。因其分子量大以及极性高等特征,理论上是无法穿过BBB到达大脑的(从该药的目标人群上看应该也不会有大幅度的BBB渗漏)。因此,在其发挥疗效的机制研究上,研究人员另辟蹊径从肠道微生物的角度对其进行了研究,最终也确实找到了能够很好支撑其疗效的理论依据[26]。
最后,随着生物技术的蓬勃发展,老的机理也越来越多地被发现是错误的或者不是唯一的,所以谁又能保证说像奥西替尼这样的被公认为是通过抑制EGFR从而发挥药效的药物没有其他的机制呢,比如说肠道菌群,比如说免疫反应。因此,笔者始终相信对于生物体的探索永远都是没有尽头的,需要沉下心来以科学的态度和方式不断探索和修正。
参考文献
[2] L. C. Costantini, J. C. Bakowska, X. O. Breakefield, O. Isacson, Gene therapy in the CNS, Gene Ther, 2000, 7(2): 93-109
[3] M. Hocquemiller, L. Giersch, M. Audrain, S. Parker, N. Cartier, Adeno-Associated Virus-Based Gene Therapy for CNS Diseases, Hum Gene Ther, 2016, 27(7): 478-496
[4] Vera Neves, Frederico Aires-da-Silva, Sofia Corte-Real, Miguel A. R. B. Castanho, Antibody Approaches To Treat Brain Diseases, Trends Biotechnol, 2016, 34(1): 36-48
[5] Consortium International Transporter, K. M. Giacomini, S. M. Huang, D. J. Tweedie, L. Z. Benet, K. L. Brouwer, X. Chu, A. Dahlin, R. Evers, V. Fischer, K. M. Hillgren, K. A. Hoffmaster, T. Ishikawa, D. Keppler, R. B. Kim, C. A. Lee, M. Niemi, J. W. Polli, Y. Sugiyama, P. W. Swaan, J. A. Ware, S. H. Wright, S. W. Yee, M. J. Zamek-Gliszczynski, L. Zhang, Membrane transporters in drug development, Nat Rev Drug Discov, 2010, 9(3): 215-236
[6] J. Lam, S. Baello, M. Iqbal, L. E. Kelly, P. T. Shannon, D. Chitayat, S. G. Matthews, G. Koren, The ontogeny of P-glycoprotein in the developing human blood-brain barrier: implication for opioid toxicity in neonates, Pediatr Res, 2015, 78(4): 417-421
[7] Jean-Marie Nicolas, Species Differences and Impact of Disease State on BBB, Blood‐Brain Barrier in Drug Discovery, 2015, 66-93
[8] A. Saleem, G. E. Searle, L. M. Kenny, M. Huiban, K. Kozlowski, A. D. Waldman, L. Woodley, C. Palmieri, C. Lowdell, T. Kaneko, P. S. Murphy, M. R. Lau, E. O. Aboagye, R. C. Coombes, Lapatinib access into normal brain and brain metastases in patients with Her-2 overexpressing breast cancer, EJNMMI Res, 2015, 5: 30
[9] H. J. Stemmler, M. Schmitt, A. Willems, H. Bernhard, N. Harbeck, V. Heinemann, Ratio of trastuzumab levels in serum and cerebrospinal fluid is altered in HER2-positive breast cancer patients with brain metastases and impairment of blood-brain barrier, Anticancer Drugs, 2007, 18(1): 23-28
[10] C. Liang, J. Zhao, J. Lu, Y. Zhang, X. Ma, X. Shang, Y. Li, X. Ma, M. Liu, X. Wang, Development and Characterization of MDR1 (Mdr1a/b) CRISPR/Cas9 Knockout Rat Model, Drug Metab Dispos, 2019, 47(2): 71-79
[11] M. S. Alavijeh, M. Chishty, M. Z. Qaiser, A. M. Palmer, Drug metabolism and pharmacokinetics, the blood-brain barrier, and central nervous system drug discovery, NeuroRx, 2005, 2(4): 554-571
[12] Q. Wang, J. D. Rager, K. Weinstein, P. S. Kardos, G. L. Dobson, J. Li, I. J. Hidalgo, Evaluation of the MDR-MDCK cell line as a permeability screen for the blood-brain barrier, Int J Pharm, 2005, 288(2): 349-359
[13] Silvia Dei, Laura Braconi, Maria Novella Romanelli, Elisabetta Teodori, Recent advances in the search of BCRP- and dual P-gp/BCRP-based multidrug resistance modulators, Cancer Drug Resistance, 2019,
2(3): 710-743
[14] A. Obaidat, M. Roth, B. Hagenbuch, The expression and function of organic anion transporting polypeptides in normal tissues and in cancer, Annu Rev Pharmacol Toxicol, 2012, 52: 135-151
[15] M. Roth, A. Obaidat, B. Hagenbuch, OATPs, OATs and OCTs: the organic anion and cation transporters of the SLCO and SLC22A gene
superfamilies, Br J Pharmacol, 2012, 165(5): 1260-1287
[16] N. E. Shepardson, G. M. Shankar, D. J. Selkoe, Cholesterol level and statin use in Alzheimer disease: II. Review of human trials and recommendations, Arch Neurol, 2011, 68(11): 1385-1392
[17] P. Ballard, J. W. Yates, Z. Yang, D. W. Kim, J. C. Yang, M. Cantarini, K. Pickup, A. Jordan, M. Hickey, M. Grist, M. Box, P. Johnstrom, K. Varnas, J. Malmquist, K. S. Thress, P. A. Janne, D. Cross, Preclinical Comparison of Osimertinib with Other EGFR-TKIs in EGFR-Mutant NSCLC Brain Metastases Models, and Early Evidence of Clinical Brain Metastases
Activity, Clin Cancer Res, 2016, 22(20): 5130-5140
[18] V. Pareek, M. Welch, E. Ravera, R. L. Zampolin, L. V. Sequist, B. Halmos, Marked Differences in CNS Activity among EGFR Inhibitors: Case Report and Mini-Review, J Thorac Oncol, 2016, 11(11): e135-e139
[19] Z. Yang, Q. Guo, Y. Wang, K. Chen, L. Zhang, Z. Cheng, Y. Xu, X. Yin, Y. Bai, S. Rabbie, D. W. Kim, M. J. Ahn, J. C. Yang, X. Zhang, AZD3759, a BBB-penetrating EGFR inhibitor for the treatment of EGFR mutant NSCLC with CNS metastases, Sci Transl Med, 2016, 8(368): 368ra172
[20] Dong-Wan Kim, James Chih-Hsin Yang, Kan Chen, Ziqiang Cheng, Lucy Yin, Paul David Martin, Zhenfan Yang, Haiyi Jiang, Myung-Ju Ahn, AZD3759, an EGFR inhibitor with blood brain barrier (BBB) penetration for the treatment of non-small cell lung cancer (NSCLC) with brain metastasis (BM): Preclinical evidence and clinical cases, Journal of Clinical Oncology, 2015, 33(15_suppl): 8016-8016
[21] J. Rautio, M. Gynther, K. Laine, LAT1-mediated prodrug uptake: a way to breach the blood-brain barrier?, Ther Deliv, 2013, 4(3): 281-284
[22] K. Liang, Z. Li, Y. Luo, Q. Zhang, F. Yin, L. Xu, H. Chen, H. Wang, Intelligent Nanocomposites with Intrinsic Blood-Brain-Barrier Crossing Ability Designed for Highly Specific MR Imaging and Sonodynamic Therapy of Glioblastoma, Small, 2020, 16(8): e1906985
[23] J. Sevigny, P. Chiao, T. Bussiere, P. H. Weinreb, L. Williams, M. Maier, R. Dunstan, S. Salloway, T. Chen, Y. Ling, J. O’Gorman, F. Qian, M. Arastu, M. Li, S. Chollate, M. S. Brennan, O. Quintero-Monzon, R. H. Scannevin, H. M. Arnold, T. Engber, K. Rhodes, J. Ferrero, Y. Hang, A. Mikulskis, J. Grimm, C. Hock, R. M. Nitsch, A. Sandrock, The antibody aducanumab reduces Abeta plaques in Alzheimer’s disease, Nature, 2016, 537(7618): 50-56
[24] W. M. Pardridge, Blood-Brain Barrier and Delivery of Protein and Gene Therapeutics to Brain, Front Aging Neurosci, 2019, 11: 373
[25] C. L. Shaffer, S. M. Osgood, D. L. Smith, J. Liu, P. E. Trapa, Enhancing ketamine translational pharmacology via receptor occupancy normalization, Neuropharmacology, 2014, 86: 174-180
[26] X. Wang, G. Sun, T. Feng, J. Zhang, X. Huang, T. Wang, Z. Xie, X. Chu, J. Yang, H. Wang, S. Chang, Y. Gong, L. Ruan, G. Zhang, S. Yan, W. Lian, C. Du, D. Yang, Q. Zhang, F. Lin, J. Liu, H. Zhang, C. Ge, S. Xiao, J. Ding, M. Geng, Sodium oligomannate therapeutically remodels gut microbiota and suppresses gut bacterial amino acids-shaped neuroinflammation to inhibit Alzheimer’s disease progression, Cell Res, 2019, 29(10): 787-803
– END –
免责声明
内容仅供感兴趣的个人谨慎参考,非商用,非医用、非投资用。版权归作者。衷心感谢!
本文为转载,药时代持中立态度,请理性阅读
版权声明:文中图片取自网络,根据CC0协议使用,版权归拥有者。
任何问题,请与我们联系。衷心感谢!
曾经的无名之辈成为AML缓解期患者的首款持续治疗药物,BMS是否会继续向它下注?
如何避免PD-L1、4-1BB联合使用瓶颈?且看性能良好的三特异性抗体“NM21-1480”完成首例患者给药



本文转载自赛默罗生物,本文观点不代表药时代DrugTimes立场。


 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
