
本文转自医世象,点击阅读原文
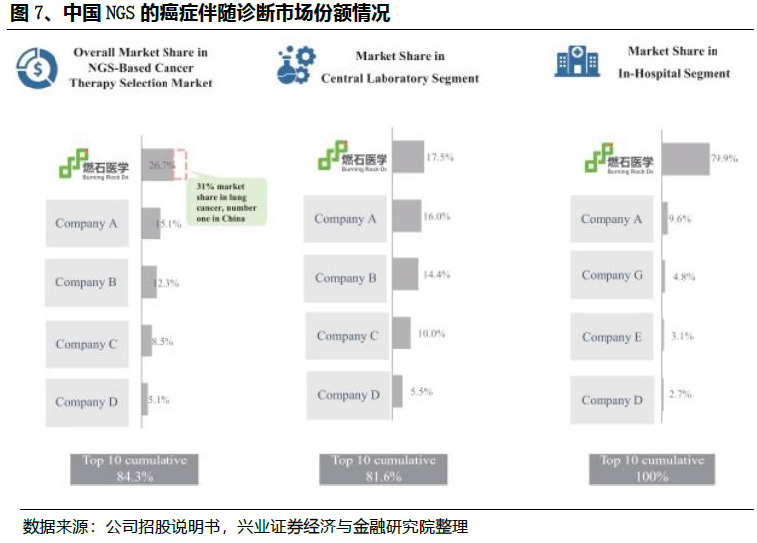
NGS伴随诊断在中国发展空间大。目前NGS癌症伴随诊断的渗透在中国仍然很低,主要是由于医生的意识不高和靶向治疗的可用性有限。在2019年,中国仅有6.4%的晚期癌症患者被建议进行癌症基因分型检测的癌症患者采用NGS癌症伴随诊断检测,而美国这一比例达到23.5%。2019年,靶向治疗和免疫治疗占中国各类癌症治疗收入的26.7%,明显低于美国的85.6%。未来随着药物可及性上升以及渗透率的不断提高,未来中国NGS癌症伴随诊断市场预计将从2019年的3亿美元增加到2030年的45亿美元。至今,贝瑞基因、华大基因、艾德生物、燃石医学、泛生子相继上市,预计后续还会有更多基因测序公司登陆资本市场,总体来说,这个行业在国内还处在起步期,我们会持续跟踪产业发展和动态。
伴随诊断在中国成长动力充足。
1)市场驱动:NMPA加快了靶向治疗和免疫治疗的审批程序,这些治疗需要在给药前进行癌症基因分型,因此反过来也会加快NGS癌症伴随诊断的增长。
2)政策层面支持:精准肿瘤被列为十三五规划扶持的新型战略产业之一;中国政府对于靶向治疗的药物给予更多报销政策;政府正在加快公众对癌症的早期筛查、早期诊断和早期治疗。
3)人口老龄化以及公众对于伴随诊断重要性的认知。
报告正文
1、行业概况
1.1、中国肿瘤行业现状
1.1.1 流行病学特征:中国发病率高
1.1.3 中国癌症药物可及性:政府已采取多种方式提高可及性,但与美国相比仍有差距
中国已经采取了多项措施来推进癌症治疗和控制癌症治疗费用,包括建立20个省级癌症中心,以提高癌症的预防和治疗。中国建立了癌症登记系统,截至2019年2月,全国共有574家癌症登记机构,覆盖4.38亿人。此外,在与制药公司进行价格谈判后,中国将于2019年将8种抗癌药物列入国家医保目录(“NDRL”),并大幅降价。此外,中国在药品审批制方面采取了快速通道,让更多国产新药、创新药和进口药对中国患者可及。中国还设立了临床试验专项审批渠道,如果没有向申请人提出询问或反馈负面意见,之前审批时间需要2-3年,但目前只需60天。随着新型抗癌药物的普及,精准肿瘤学的应用,尤其是癌症分子谱的应用将会进一步提高。
但目前癌症诊断和治疗方面与美国相比仍有差距。2019年,靶向治疗和免疫治疗占中国各类癌症治疗收入的26.7%,明显低于美国的85.6%,而靶向治疗和免疫治疗可以避免化疗的严重副作用,并可能取得更好的治疗效果,有望成为中国癌症治疗市场新的治疗标准。因此,癌症基因分型,即识别与患者癌症相关的特定基因组改变和生物标记,在中国正被越来越多地采用,因为它为医生利用靶向治疗和免疫治疗制定个性化治疗计划提供了宝贵的帮助。
1.2、NGS肿瘤基因检测在市场中的应用范围:四大应用范围
先进快速测序技术的引入、生物信息学领域的进步、政府政策的扶持、不断提高的可负担性以及中国精准医疗意识的增强,推动了肿瘤基因检测行业的市场增长。
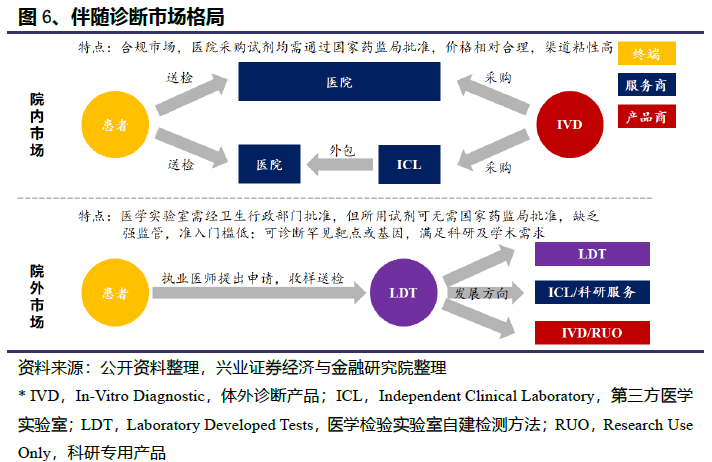
肿瘤基因检测主要应用可以分为三个部分,包括(1)伴随诊断,评估患者基因组谱,帮助治疗选择;(2)早期筛查,识别特定的分子标志物,使癌症在高危人群中早期发现;(3)分子残留病检验,服务于治疗后的癌症患者,作为癌症复发的预防检测方法;(4)开发服务,主要包括与生物制药公司、医院和研究机构合作开发新的试验和治疗方法。
1.2.1、癌症伴随诊断产品市场:市场潜力巨大,几大成长动力共同驱动
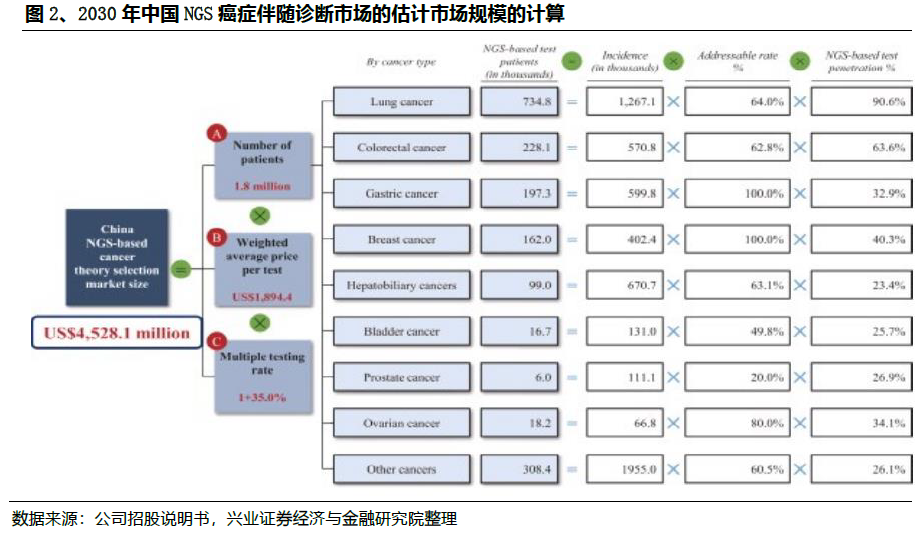
1)在中国伴随诊断的规模:2030年规模将达45亿美元
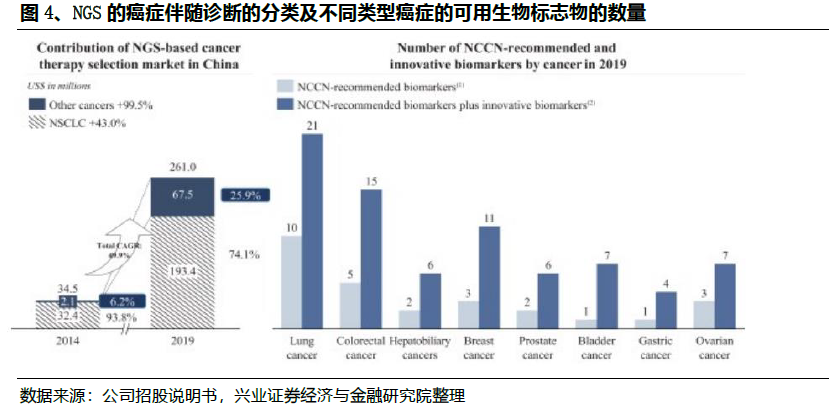
与传统的癌症基因分型方法不同,NGS癌症伴随诊断可以在一次单一检测中同时检测到与患者癌症相关的所有基因组改变和生物标志物,显著降低了成本,同时提高了准确性。目前针对各类癌种的相关标志物和靶向以及免疫治疗的种类已经比较丰富。
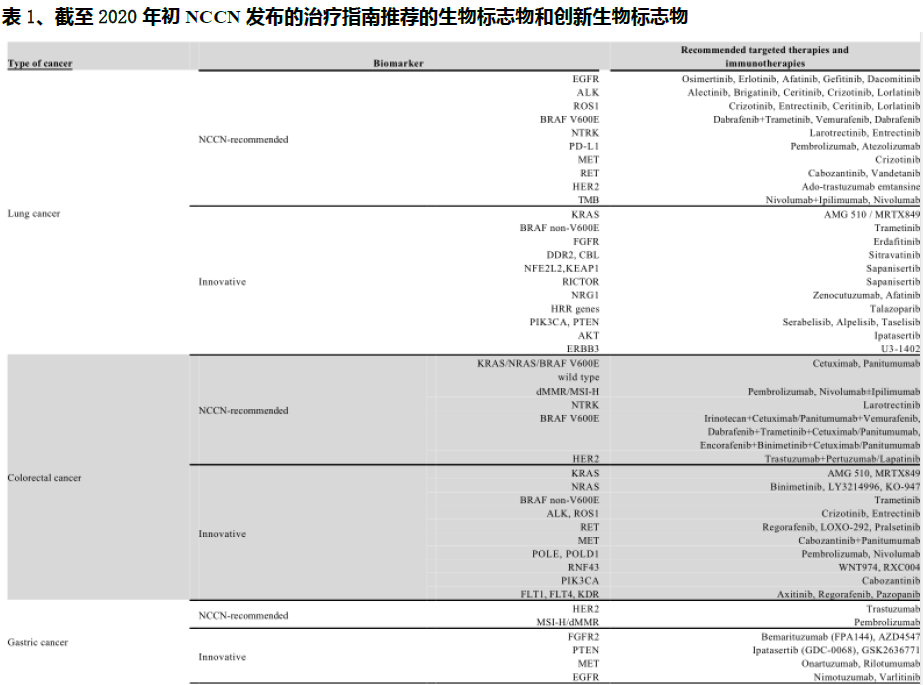
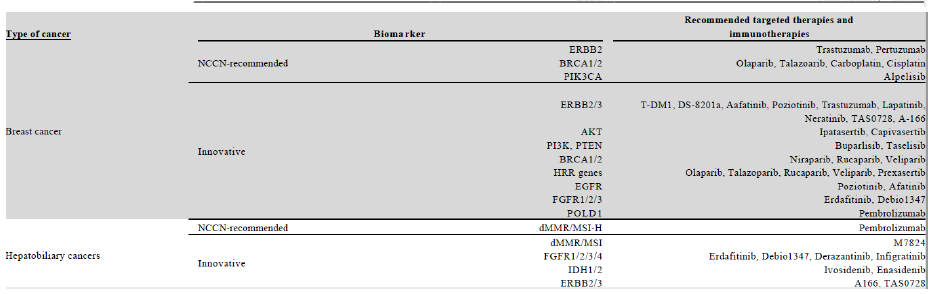
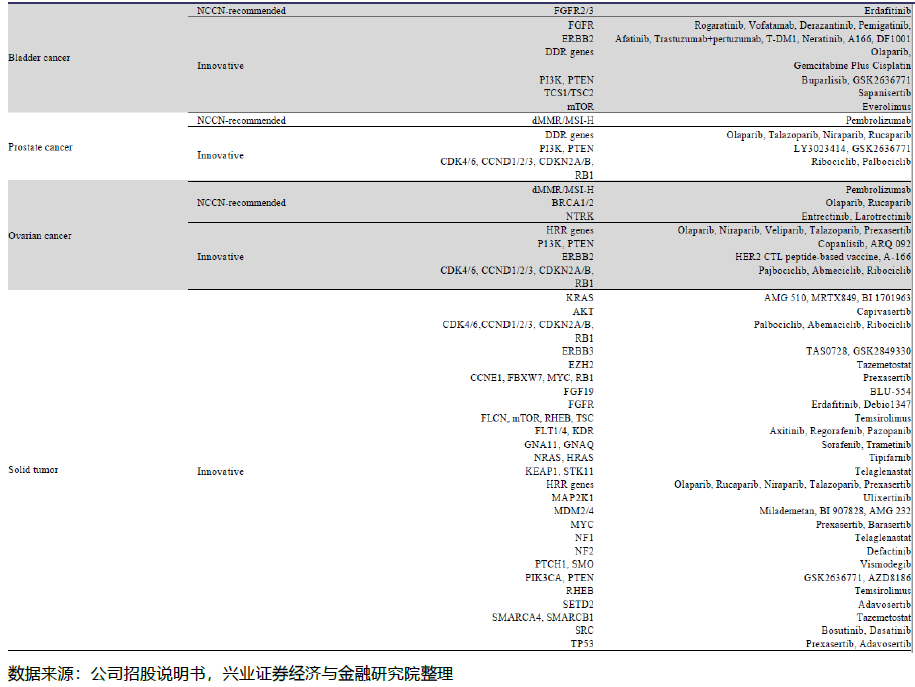
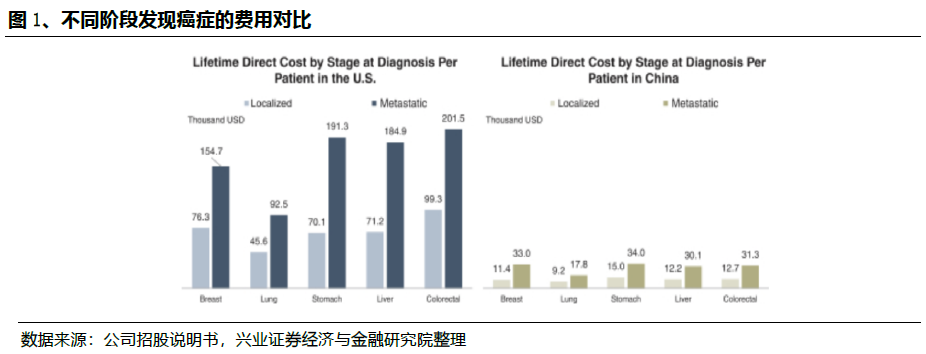
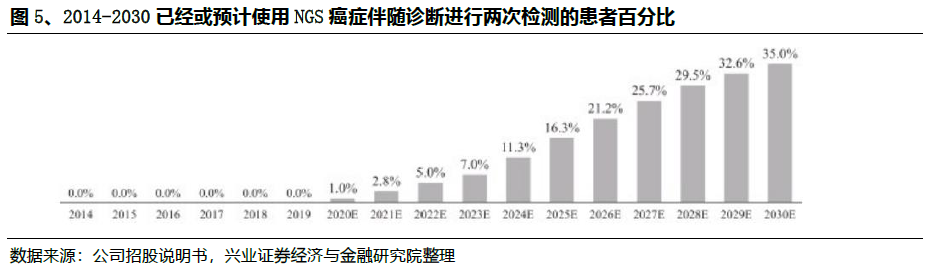
尽管有巨大的未满足的市场需求,但目前NGS癌症伴随诊断的渗透在中国仍然很低,主要是由于医生的意识不高和靶向治疗的手段有限。在2019年,中国仅有6.4%的晚期癌症患者和被建议进行癌症基因分型检测的癌症患者采用了NGS癌症伴随诊断检测,而美国这一比例达到23.5%。在2030年,这个比例在中国预计将增加到45.2%。
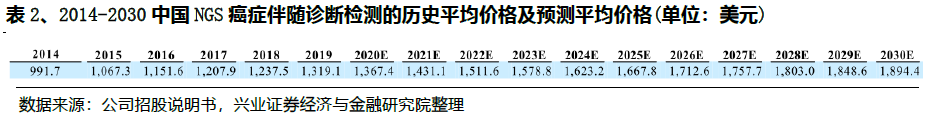
在中国,NGS癌症伴随诊断检测的平均价格从2014年的991.7美元上升到2019年的1319.1美元,预计到2030年将达到1894.4美元。
2)伴随诊断在中国的成长动力
A.加快批准靶向治疗和免疫治疗。
靶向治疗和免疫治疗在避免严重副作用的同时,可能比化疗取得更好的治疗效果,近年来逐渐成为中国癌症治疗的标准,NMPA加快了靶向治疗和免疫治疗的审批程序,这些治疗需要在给药前进行癌症基因分型,因此反过来也会加快NGS癌症伴随诊断的增长。



– END –
免责声明
内容仅供感兴趣的个人谨慎参考,非商用,非医用、非投资用。版权归作者。衷心感谢!
本文为转载,药时代持中立态度,请理性阅读
版权声明:文中图片取自网络,根据CC0协议使用,版权归拥有者。
任何问题,请与我们联系。衷心感谢!
喜讯!雅创医药原创NASH新药HPG1860获得中国临床试验许可
勃林格殷格翰携手Mirati共赴抗肿瘤战场“不可成药”的KRAS领域,新组合能否带来新突破?
“宇宙第一大药厂”辉瑞对现有管线自信满满,预测了未来10款最具潜力的重磅大药以迎接2026年的专利断崖




点击阅读原文,查看更多精彩!
本文转载自医世象,本文观点不代表药时代DrugTimes立场。


 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
