作者:优选资本 李芳
“加速审批”概念是源于1988年FDA推动艾滋病研发和上市等考虑,以加快危重疾病药物审评而被首次提出。之后美国FDA于1992年正式设立了加速审批程序(Accelerated approval),在2012年国会又通过《食品和药品管理局安全创新法案》(FDASIA)中的第901节进行修订,同意FDA采用替代终点或中间终点来加速重大疾病药物的批准。在此之前所有上市药物均是通过一种常规审批程序(Regullar approval)获得批准。
获取K药、O药加速审批列表及其他加速审批上市后经验证又被撤市的信息列表,关注公众号,对话框输入“AA”。
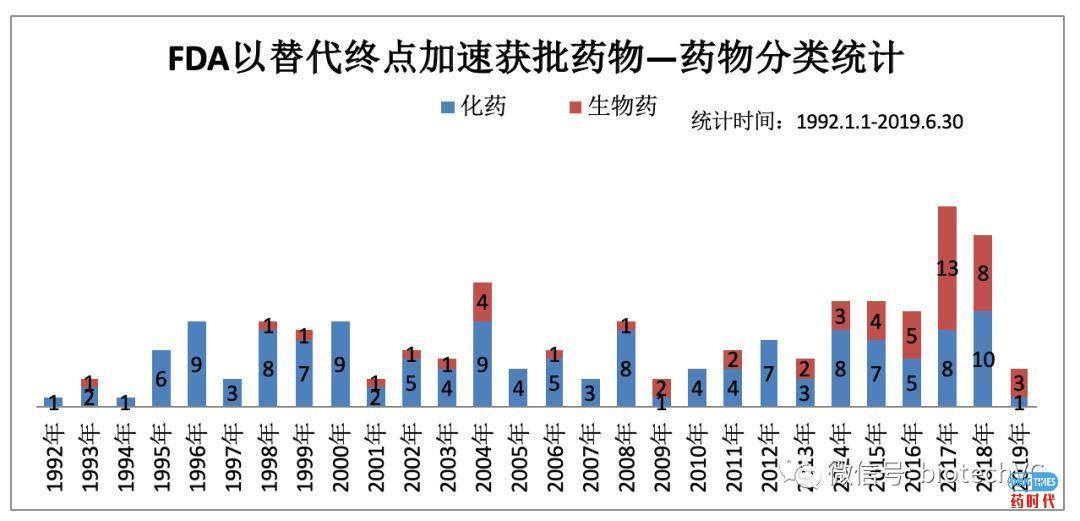
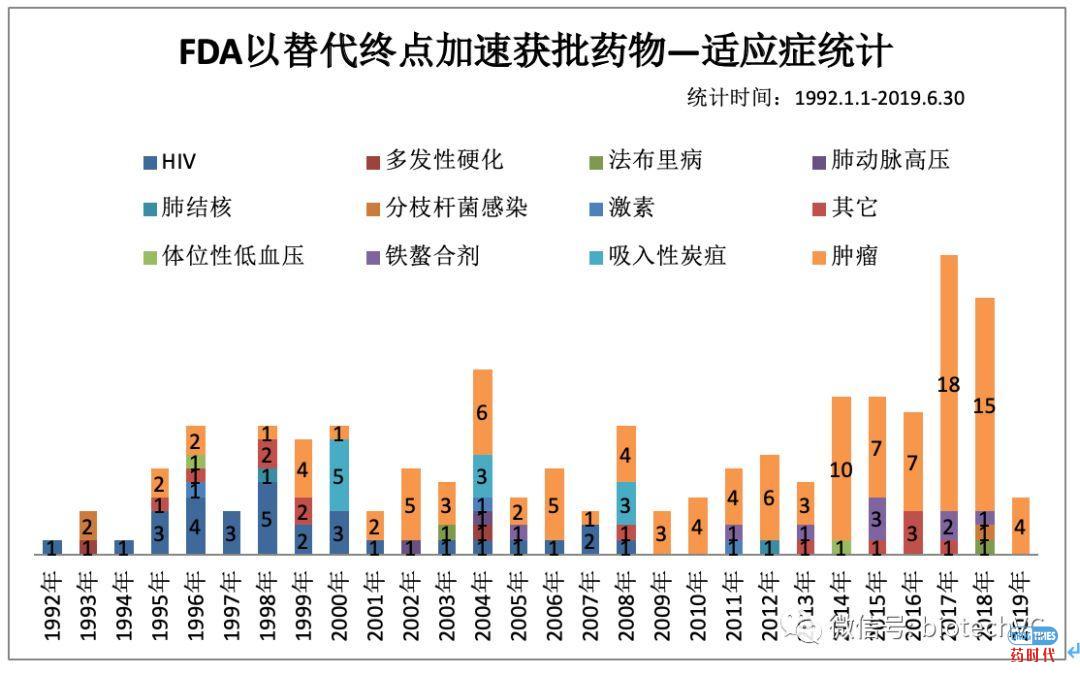
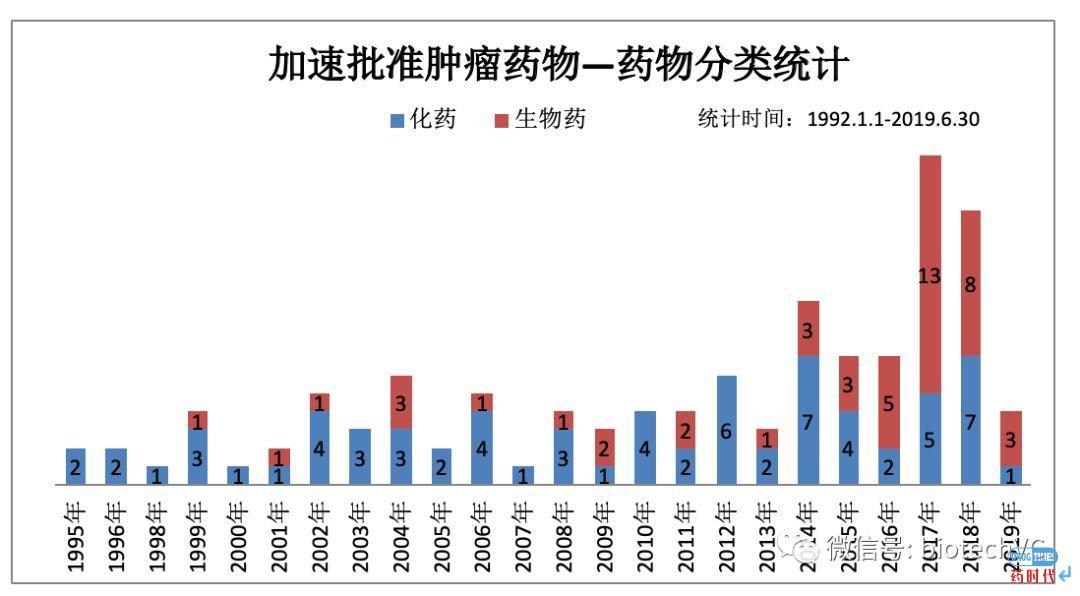
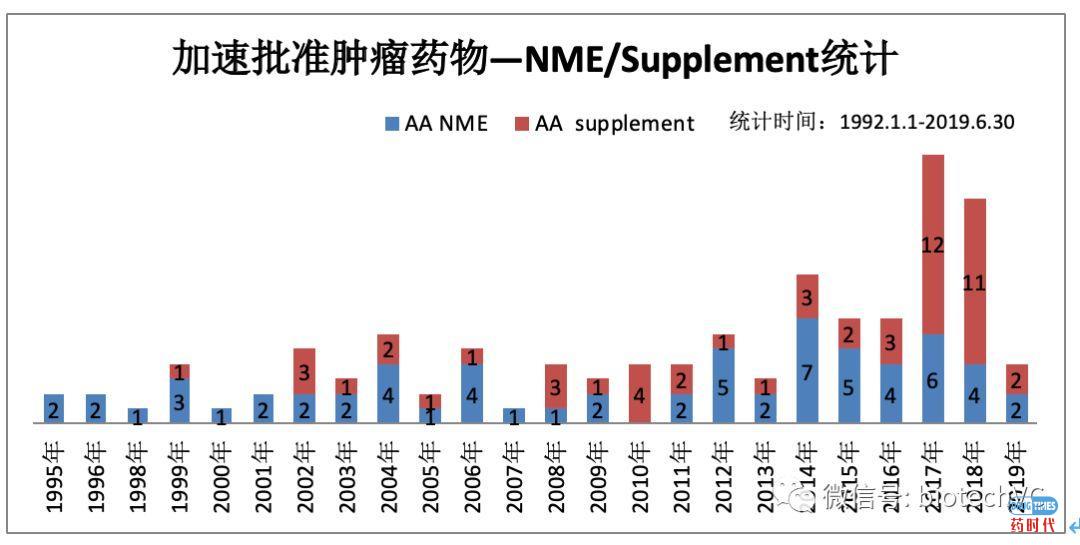
图4 肿瘤药物NME/Supplement分类统计
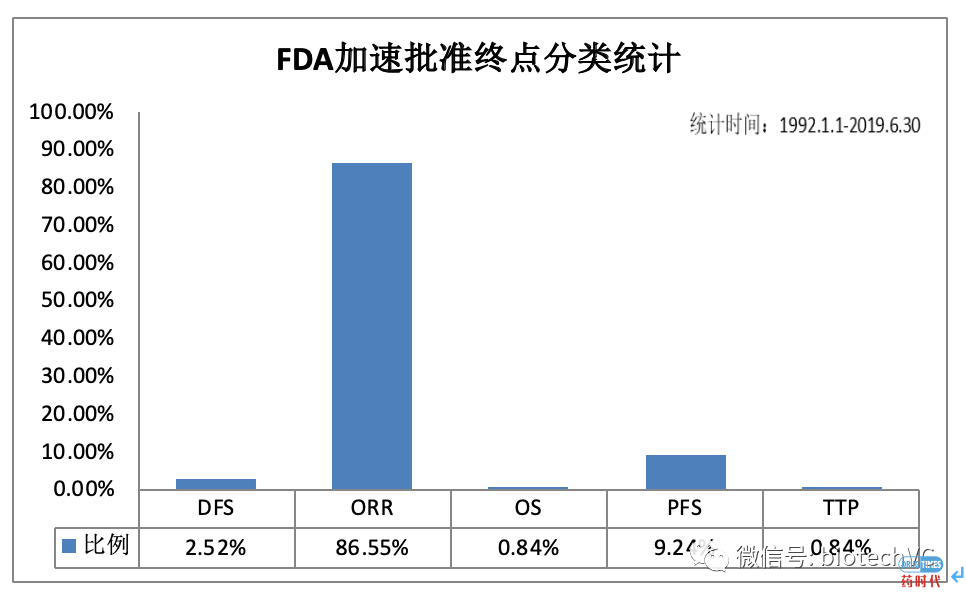
图5 肿瘤药物替代终点分类统计
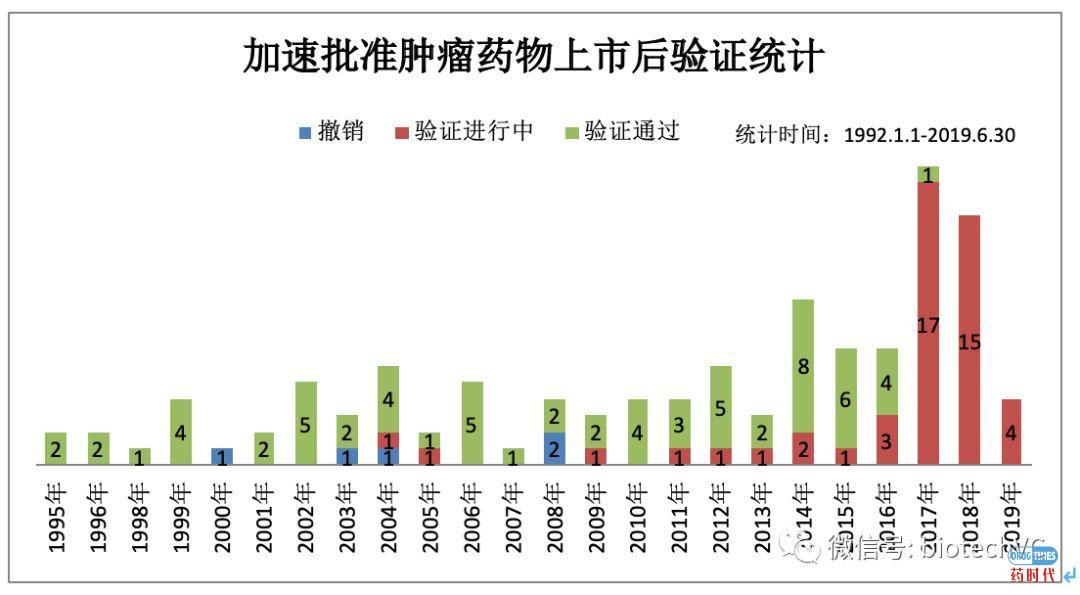
图6 肿瘤药物验证分类统计
三.FDA历年来以ORR作为替代终点加速审批的肿瘤药物
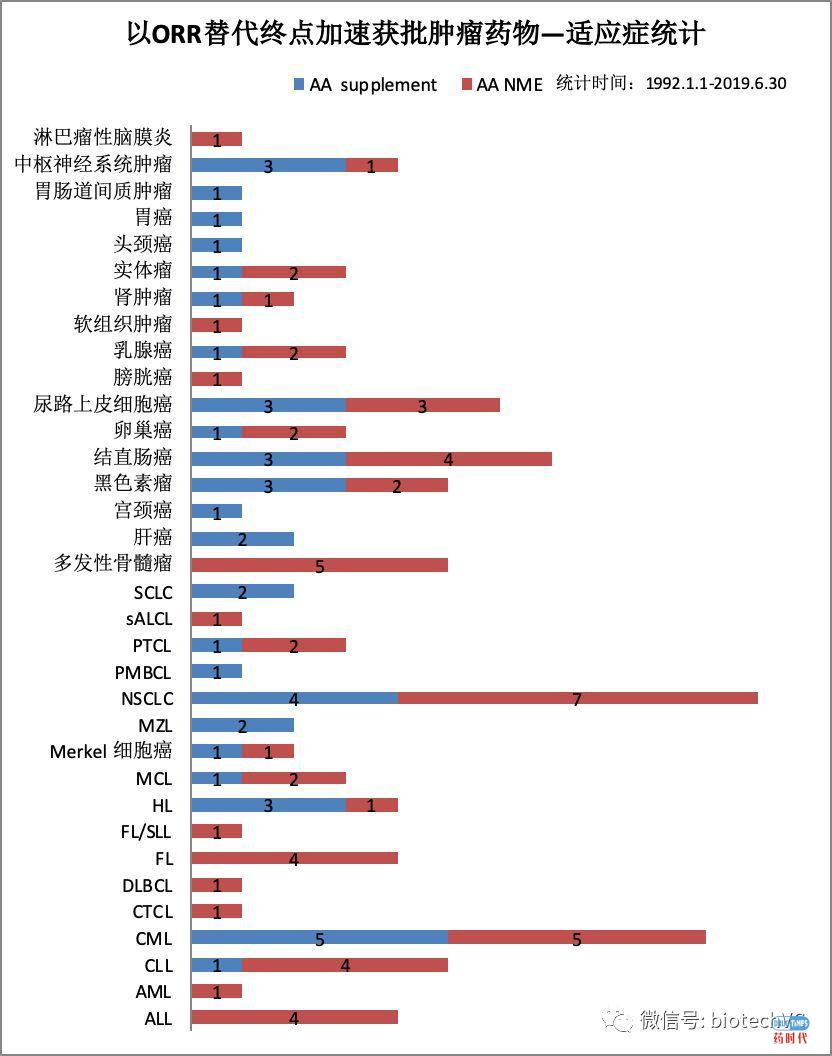
图7 肿瘤ORR替代终点适应症分类统计
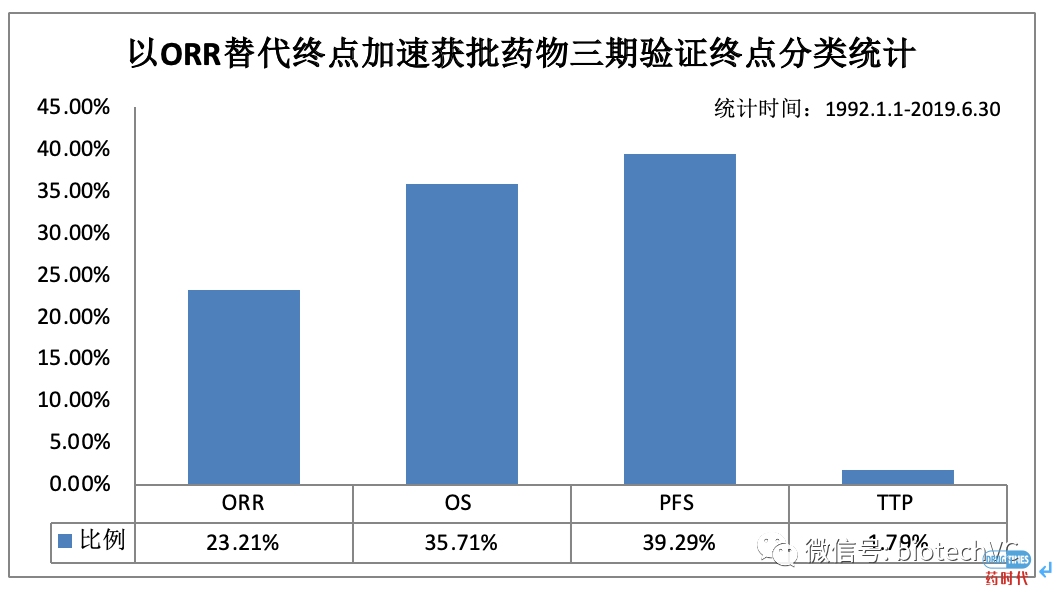
图8 三期验证性试验终点分类统计
发布者:药时代,转载请首先联系contact@drugtimes.cn获得授权

 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
