
《我和我的药时代》| 医药版《我和我的祖国》(诚聘歌手演唱)

(来源:FDA官网)
FDA了批准阿斯利康公司的奥希替尼(Tagrisso,osimertinib)作为肿瘤具有特定类型的基因突变的非小细胞肺癌患者的首个辅助治疗方法。

(图片来源:杂志官网截屏)


Vivek Ramaswamy
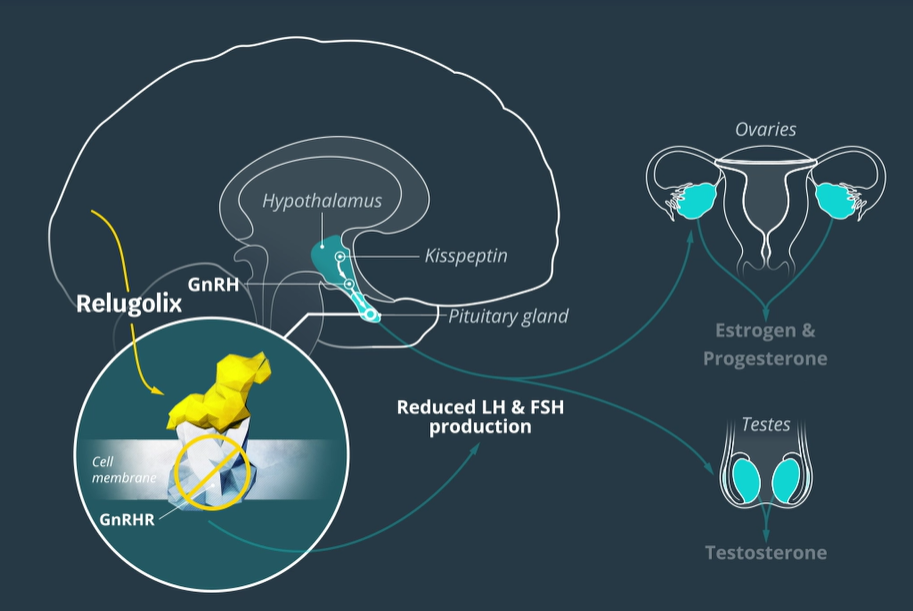
▲Orgovyx的作用机制示意图(图片来源:Myovant Sciences官网)
预祝广大的朋友们节日快乐!
参考资料:
-
– FDA Takes Additional Action in Fight Against COVID-19 By Issuing Emergency Use Authorization for Second COVID-19 Vaccine
-
– FDA Approves First Adjuvant Therapy for Most Common Type of Lung Cancer -
– FDA Approves Prosthetic Implant for Above-the-Knee Amputations -
– FDA Approves First Oral Hormone Therapy for Treating Advanced Prostate Cancer -
In groundbreaking move, FDA approves Myovant’s relugolix as the first once-a-day pill for advanced prostate cancer -
FDA批准最常见肺癌类型的首个辅助疗法;礼来宣布收购神经疾病基因疗法公司Prevail
-
FDA批准口服relugolix用于治疗晚期前列腺癌
-
奥希替尼获FDA批准用于NSCLC辅助治疗
-
其它公开资料

-
【重磅新闻!】美国前总统吉米卡特脑部癌细胞消失,让世界再次聚焦PD-1/PD-L1重磅炸弹! -
【圣诞礼物!】 痛风新药!美国FDA批准阿斯利康的 Zurampic(LESINURAD) -
【圣诞礼物!】美国FDA批准新的孤儿药治疗肺动脉高血压(PAH)!美国罕见病,中国常见病!我们一起关注! -
注意!FDA提前批准新药上市,或成常态 -
年终大盘点!2020年FDA批准的抗癌新药:十大癌症迎来22款新疗法 -
吴一龙教授:新冠的流行病学和病情特点及防控要点 -
吴一龙教授 | 肺癌那些事儿:2019大事件 -
吴一龙教授2019年ESMO参会感想 | 坐看江湖风云变幻,乐见甘霖惠及众生! -
吴一龙深度采访:NSCLC突破性靶向药物进入国家医保目录有益民生 -
吴一龙教授:把免疫治疗当“最后一根救命稻草”?效果可能很糟糕! -
【柳叶刀】莫树锦、吴一龙教授牵头KEYNOTE-042研究结果正式发布 -
吴一龙教授:未来三年是免疫治疗的关键发展期!药品高质量是民族药企取胜之道
药时代,我们帮您找到理想的新药合作伙伴!

《我和我的药时代》| 医药版《我和我的祖国》(诚聘歌手演唱)

 点击阅读原文,把握更多价值资讯!
点击阅读原文,把握更多价值资讯!发布者:药时代,转载请首先联系contact@drugtimes.cn获得授权


 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
