

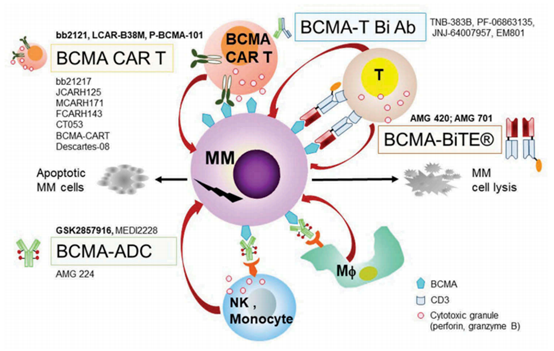
(CAR-T细胞治疗、抗体偶联药物、双特异性抗体)[1]
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
参考文献
[2] https://www.liangyihui.net/
[3] InternationalAgency for ReaserchResearch on Cancer of World Health Organization. The GlobalCancer Observatory. Multiple Myeloma China Fact Sheet [EB/OL]. 2019, https://gco. iarc. fr/today/fact-sheets-cancers
[4] Janssen PresentsFirst Data from Phase 1 Study of BCMAxCD3 Bispecific Teclistamab in Patientswith Heavily Pretreated Relapsed or Refractory Multiple Myeloma. Retrieved2020-05-18, fromhttps://www.janssen.com/janssen-presents-first-data-phase-1-study-bcmaxcd3-bispecific-teclistamab-patients-heavily
[5] 强生公司2019年度财报
[6] 百时美施贵宝2019年度财报
[7] 国信证券研究报告
[8] https://www.nature.com/articles/d41586-020-03229-w
版权声明:文中图片取自网络,根据CC0协议使用,版权归拥有者。
任何问题,请与我们联系。衷心感谢!

 点击直达,每月2万多朋友到过这里!
点击直达,每月2万多朋友到过这里!
本文转载自药渡,本文观点不代表药时代DrugTimes立场。


 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
