
聂云波
中南大学硕士,毕业于湘雅药学院。加入博腾前,曾在长沙晶易就职,主要从事固体制剂和外用制剂的开发,在外用制剂的开发拥有一定的项目经验。
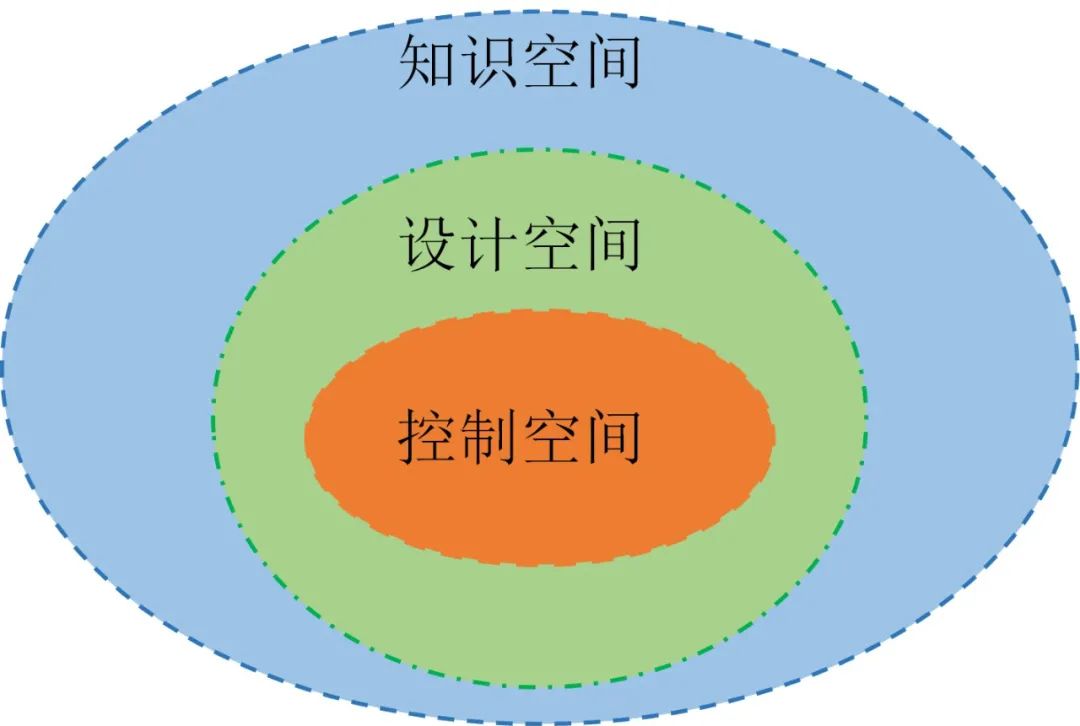
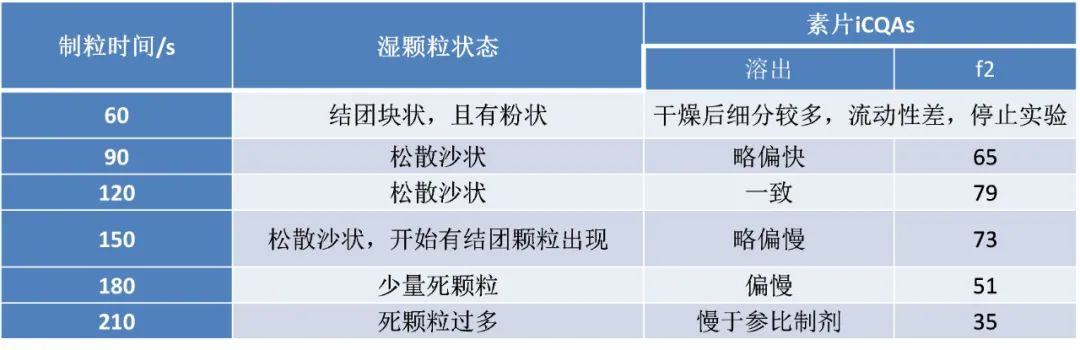
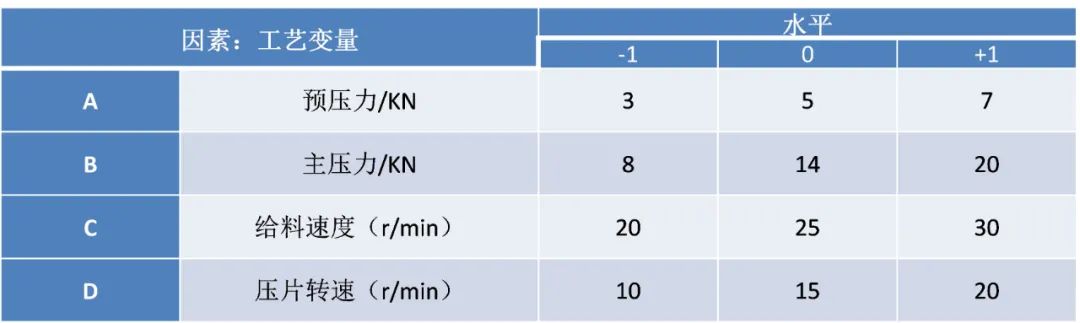
– END –

 点击直达,每月2万多朋友到过这里!
点击直达,每月2万多朋友到过这里!
发布者:药时代,转载请首先联系contact@drugtimes.cn获得授权

聂云波
中南大学硕士,毕业于湘雅药学院。加入博腾前,曾在长沙晶易就职,主要从事固体制剂和外用制剂的开发,在外用制剂的开发拥有一定的项目经验。



– END –

 点击直达,每月2万多朋友到过这里!
点击直达,每月2万多朋友到过这里!
发布者:药时代,转载请首先联系contact@drugtimes.cn获得授权
 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来!
