⬆️ 欢迎参加2020中国NASH 大会!
本文转自药渡 ,作者药渡咨询 郭雷团队,点击阅读原文
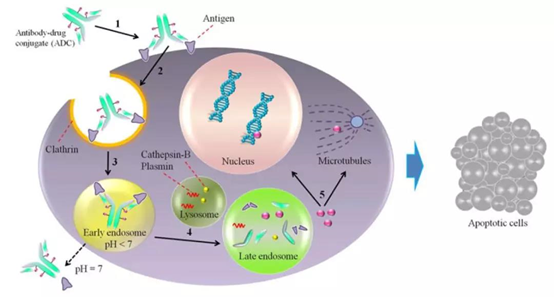
AD Cs(antibody-drugconjugates)技术是通过linker将单抗和药物分子偶联在一起,利用抗体 的特异性靶向 运输药物分子到靶组织发挥作用,降低药物的系统性毒副作用,提高药物治疗窗和拓展抗体治疗潜能[1]。血液中循环的ADC 与靶抗原 结合后,通过网格蛋白介导的内吞作用被内化(图1)[2]。内化的复合物随后进入内体-溶酶体途径,大多数情况下,先被转运至早期的内体,然后转运至溶酶体。酸性环境和蛋白水解酶会导致包含ADC 的溶酶体降解,从而使细胞毒性药物释放到细胞质中。释放的细胞毒性药物随后流出到细胞质中,通过DNA插入或抑制微管合成等方式诱导细胞凋亡。因此正确的靶标、抗体、linker以及cytotoxic payloads成为影响ADC
ADC的成功开发依赖于抗体对靶抗原的特异性结合,理想的ADC靶标是在肿瘤 细胞表面高表达,在正常组织低表达或不表达,或至少限定在特定的组织中,例如CD138,5T4,mesothelin,leukemia和 CD3 7。在正常组织表达的靶标会摄入ADC药物,不仅导致“脱靶”毒性效应,而且降低癌组织内富集的ADC剂量,降低ADC药物治疗窗。 有效的ADC活性与细胞表面的抗原数量相关,研究证明,实现有效的ADC活性,细胞表面至少需要104的抗原才能确保致死剂量的细胞毒性药物被递送到细胞内部。由于肿瘤细胞表面上抗原的数量有限(平均每个细胞表面约5,000至106数量的抗原),而且大多数临床阶段的ADC药物平均DAR为3.5至4,所以ADC药物传递到肿瘤细胞内的很少。这也被认为ADC合并常规细胞毒性药物如甲氨蝶呤,紫杉醇 和蒽环类抗生素 的临床失败的主要原因之一。 除了特异性和足够的表达,最佳的靶抗原还应引起有效的ADC内在化。抗体与靶细胞表面抗原的结合可以触发抗体-抗原复合物进入细胞的内化路径,从而实现药物的细胞内递送。 目前,白细胞表面分化抗原是最先广泛采用的ADC靶标,目前处于临床开发 阶段的20种ADC药物的靶标有10种(CD33,CD30,CD79b,CD22,CD19 ,CD56,CD138,CD74)是白细胞表面抗原。许多ADC药物靶向白细胞表面抗原在很大程度上是由于这些抗原在肿瘤组织中高表达,在正常的造血组织中不表达,或表达水平极低。
抗体分子的高度特异性是实现ADC药物疗效的基本要求,从而将细胞毒剂集中在肿瘤部位。依赖高亲和力的特异性抗体,除了避免对健康细胞的毒性外,缺乏肿瘤特异性的抗体可能会被循环系统消除,导致ADC药物还未到达肿瘤组织就已“消耗殆尽”。为此,通常将细胞毒性药物附着于mAb的Fc部分或恒定区,以防对抗原的检测 和结合产生影响。 由于这些〜150kDa的抗体分子不仅包含多个天然位点进行缀合,而且还可以被修饰用于其他反应位点,目前所有的ADC抗体都是IgG 分子。IgG分子的优势在于其对靶抗原的高亲和力和在血液中较长的半衰期,这导致其在肿瘤部位的积累增加。与其它IgG分子相比,IgG1 和IgG3的抗体依赖性细胞毒性(ADCC)和补体依赖性细胞毒性(CDC )要强的多,但由于IgG3具有较短的半衰期,所以不是ADC药物的理想选择。另外与IgG2和IgG4相比,IgG1在胞内形成的铰链容易还原,因此基于半胱氨酸生产的ADC药物难以生产。因此,由于IgG1具有相对强的ADCC和CDC,半衰期长,易于生产等特点,目前大多数ADC药物是采用IgG1支架构建[3]。 ADC的免疫 原性是循环半衰期的主要决定因素之一。早期的ADC使用鼠单克隆抗体引起人体强烈的,急性的免疫反应(HAMA),目前大多数ADC均采用人源化抗体或完全人源化抗体。 总体而言,用于ADC体系结构的理想mAb应该是能够选择性结合肿瘤细胞而不与健康细胞发生交叉反应的人源化或完全人源化IgG1分子。此外,ADC内在化可能是成功治疗的重要而非绝对因素。
毒素分子是ADC药物研发 成功的关键因素,注射入体内的抗体仅仅只有很小的一部分聚集在实体瘤组织中,因此首先具备亚纳摩尔级别的毒性分子(IC50值在0.01-0.1nM)才是合适的payloads。另外,毒性分子必须具有可偶联的合适的功能基团,强大的细胞毒性,具有疏水性,且在生理条件下非常稳定。 目前用来进行ADC药物研发的毒性分子可分为两大类:微管抑制剂 和DNA损伤剂,其它小分子 ,如α-amanitin(选择性RNA 聚合酶II抑制剂 )也在研究中[12]。前者以Seattle’s Genetics的MM AE,MMAF(free drug IC50: 10-11-10-9M)和ImmunoGen’s 公司开发的DM1,DM4(free drug IC50: 10-11-10-9M)为代表。后者以Calichemicin,duocarmycins,Spirogen’s公司的PBD (free drug IC50<10-9M)为代表,这些毒素都有相应的ADC药物在临床阶段进行探索开发。很多公司也在纷纷开发自己的payloads,例如Nerviano Medical sciences、MersanaTherapeutics等公司。
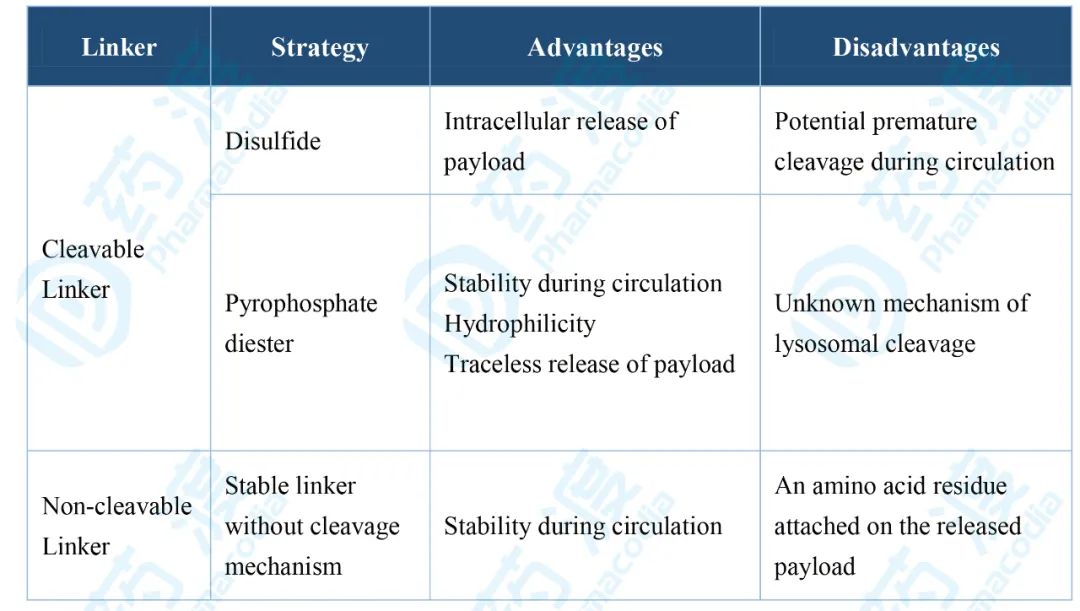
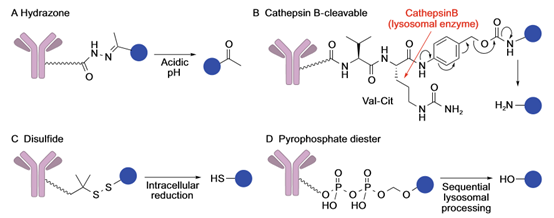
尽管根据肿瘤细胞的类型选择特异性抗体和payloads很重要,但就药代动力学 ,药理学和治疗窗口来说,通过选择合适的linker来约束抗体和payloads是成功构建ADC的关键,理想的linker必须满足以下条件:(1)linker需要在血液循环系统中稳定存在,而定位在肿瘤细胞内或附近时能快速释放活性payloads,linker的不稳定性会导致payloads的过早释放,造成对正常组织细胞的损伤。也有一项临床研究 显示,没登素生物碱的ADC稳定性与不良反应呈相反的关系。因此,对于抗体,肿瘤组织和payloads的组合,确定具有最佳稳定性的linker非常重要。(2)ADC一旦被内化到靶肿瘤组织中,linker需要具有被快速裂解并释放毒性分子的能力。(3)疏水性也是linker考虑的一个重要特性,疏水性连接集团和疏水性payloads通常会促进ADC小分子的聚集,从而引起免疫原性。 目前根据是否将linker分为两大类:一种为可切割linker(acid-labile linkers, protease cleavablelinkers,disulfide linkers),ADC药物的主要类型;另一种为不可切割的linker,区别在于是否会在细胞内被降解。 设计的可切割的linker是利用其在血液系统和肿瘤细胞的环境差异,例如,酸敏感linker通常在血液中非常稳定,但在低PH值的溶酶体中不稳定,并快速降解,释放游离活性毒分子(Mylotarg (gemtuzumab ozogamicin))。同样,对蛋白酶敏感的protease cleavable linkers在血液中很稳定,但在富含蛋白酶(识别其特定蛋白序列的)的溶酶体中,迅速被切割释放出活性毒分子,正如Val-Cit二肽交联键被胞内cathepsins酶迅速水解(Adcetris (brentuximab vedotin ) )。设计的二硫键交联的linker利用胞内还原谷胱甘肽的高水平表达,还原二硫键在胞内释放出毒性分子(IMGN-901 (anti-CD56-maytansine))。
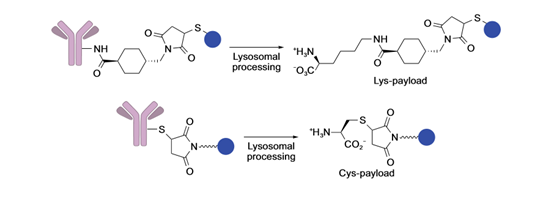
不可裂解linker由抗蛋白酶降解的稳定键构成,在血液中非常稳定,其依赖ADC抗体成分被胞质和溶酶体蛋白酶完全降解,最终释放出与降解抗体衍生的氨基酸残基相连的payload来杀伤癌细胞(例ado-trastuzumab emtansine ,T-DM1,或Kadcyla 图3 不可裂解linker,来源于参考资料4
当然,选择何种类型的linker与靶标选择密切相关。在具有可切割linker的ADC药物中,靶标为B细胞抗原(CD19,CD20,CD21,CD22,CD79B,CD180)的,被证实在体内非常有效。相反,带有不可切割linker 的ADC药物中,被证实在体内内吞并快速转运到溶酶体的靶标包括CD22,CD79b。 保证游离药物在肿瘤细胞内特异释放是选择Linker的最终目标,同时对药物毒性的控制也非常重要。最终要通过case by case的分析来决定如何优化选择合适linker, 靶标和毒物分子来平衡ADC药物的有效性和毒性。 肿瘤药物 的开发可追溯至二十世纪中期,人们发现氮芥通过靶向快速分裂的癌细胞来破坏个体的骨髓和淋巴组织。这类药物包括叶酸和嘌呤类似物(甲氨蝶呤和6-巯基嘌呤),微管聚合抑制剂/促进剂(长春花生物碱和紫杉烷类)和DNA破坏剂(蒽环类和氮芥类)[2]。由于早期的肿瘤治疗 药物不仅靶向癌细胞而且对体内所有的分裂细胞都具有杀伤作用,导致患者发生严重的副作用,这大大限制了给药剂量,药物的治疗指数(最大耐受剂量/最小有效剂量)很低,疗窗口狭窄。ADC药物可能实现选择性地将有毒化合物递送至特异性的癌细胞。
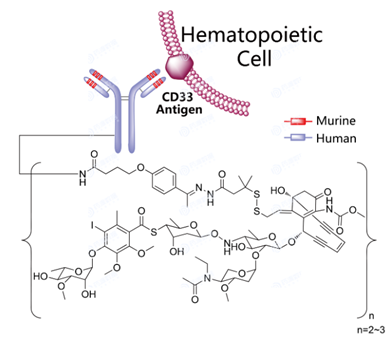
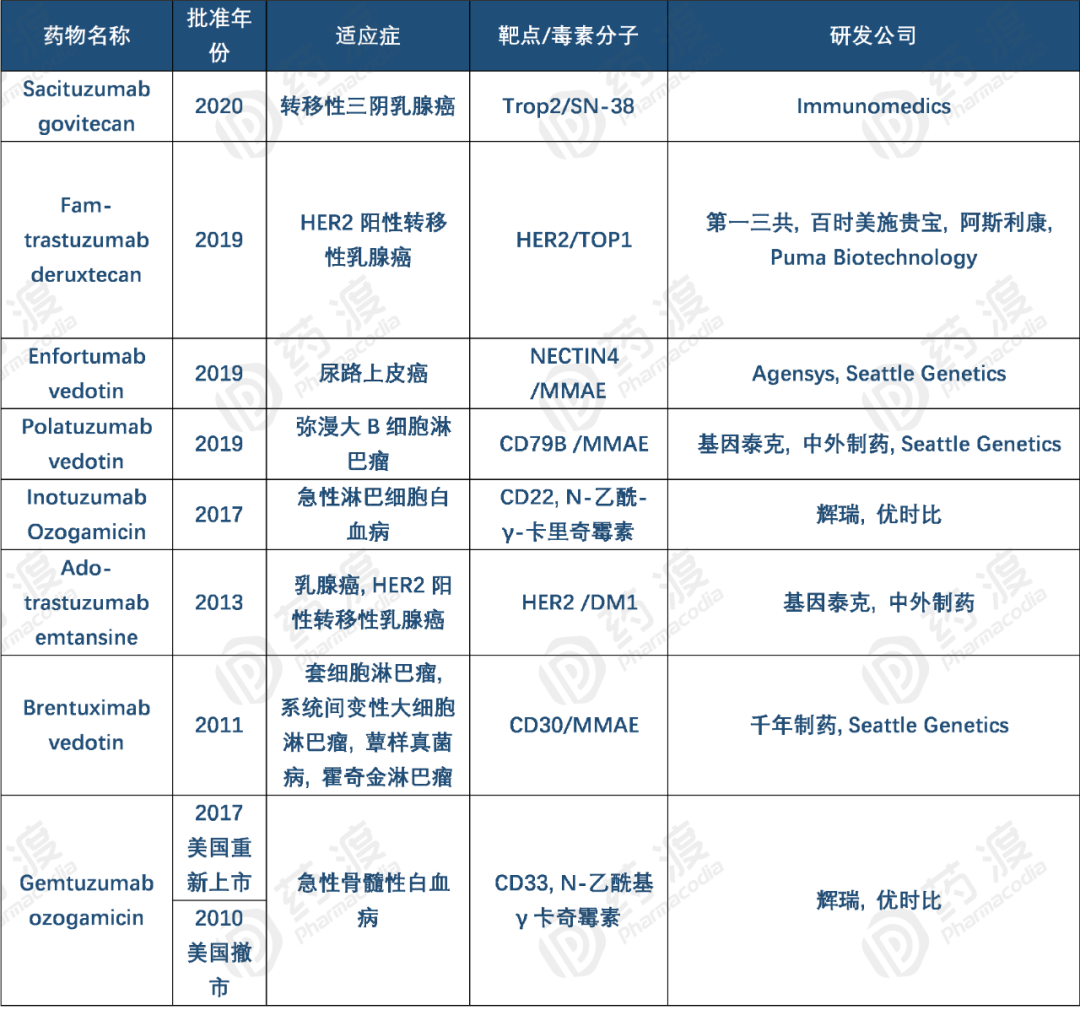
在第一代ADC药物中,丝裂霉素C,伊达比星,蒽环类,N-乙酰马法兰,阿霉素,长春花生物碱和甲氨蝶呤等抗肿瘤药物主要通过不可裂解的连接物(酰胺或琥珀酰亚胺)与鼠单抗偶联。 2000年美国FDA批准首款抗体偶联 药物Gemtuzumab Ozogamicin(商品名Mylotarg,惠氏,辉瑞 子公司),靶点为CD33,Gemtuzumab Ozogamicin由三部分构成:1)重组人源化IgG4 kappa型单抗Gemtuzumab;2)具有细胞毒性的N-乙酰基γ卡奇霉素;3)由4-(4-acetylphenoxy)-butanoic acid (AcBut) 和3-methyl-3-mercaptobutane hydrazide (dimethylhydrazide) 组成的酸裂解型双功能Linker分子。Linker分子将卡奇霉素共价连接到单抗,药物抗体比率ADR平均为2~3。该药物被靶细胞内吞后,通过水解linker释放卡奇霉素,诱导双链DNA断裂,致使细胞周期停滞并凋亡。该药用于治疗CD33阳性的急性骨髓性白血病。 图4 Gemtuzumab Ozogamicin结构式,来源:药渡数据库
随后发现,与其它抗癌药物比较Gemtuzumab Ozogamicin没有显著的临床优势,而且具有严重的肝毒性。2010年,Gemtuzumab Ozogamicin上市10年后,主动撤出市场。Gemtuzumab Ozogamicin潜在的治疗缺陷包括,连接物具有不稳定性,约48小时释放50%的化学药物;药物中的卡奇霉素具有高度疏水性,与单抗结合率为50%,毒性高,CMC 较差。此外,也有研究证明单抗Gemtuzumab可通过外排泵(MDR1和MRP1)从细胞中清除出去,与其它抗癌药物比较没有显著的临床疗效。
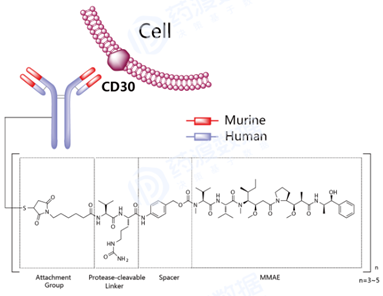
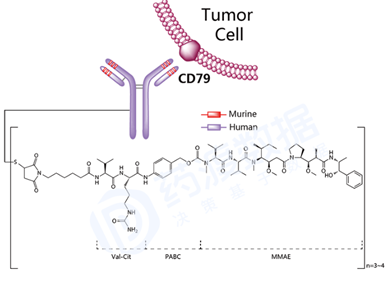
经过近10年单抗药物的迅猛发展,以及更有效的抗癌小分子药物 被陆续发现(100-1000倍)。第二代ADC药物比第一代具有更好的CMC特性。第二代药物代表包括Brentuximab vedotin,Ado-trastuzumab emtansine,InotuzumabOzogamicin。 然而,第二代药物存在治疗窗口狭窄的问题,主要原因在于低脱靶毒性,与非结合小分子药物的抗体竞争肿瘤靶点。第二代具有不同药物抗体比率(DAR)0-8。通常DAR超过4,会显示低耐受性,血浆清除效率高和体内作用效能低[3]。例如Brentuximab vedotin为4,Ado-trastuzumab emtansine为3.5,InotuzumabOzogamicin为6。 Brentuximab vedotin(商品名Adcetris)由Seattle Genetics 和Millennium(武田 制药的子公司)联合研发,2011年8月获美国FDA批准上市,靶点为CD30,由三部分构成:1)靶向CD30的嵌合型IgG1 kappa单抗Brentuximab;2)微管抑制剂MMAE(monomethyl auristatin E );3)蛋白酶裂解型linker分子maleimidocaproyl-valyl-citrullinyl-p-aminobenzyloxycarbonyl(mc-val-cit-PABC)。Linker通过半胱氨酸残基将MMAE共价偶联到单抗,药物单抗比率DAR平均为3~5。Brentuximab vedotin被靶细胞内化后,通过蛋白酶裂解下来的MMAE可结合微管蛋白并破坏细胞的微管网络,导致细胞周期停滞和细胞凋亡。适应症为霍奇金淋巴瘤 、系统性间变性大细胞淋巴瘤 、套细胞淋巴瘤 和蕈样真菌病。 图5 Brentuximab vedotin结构式,来源:药渡数据库
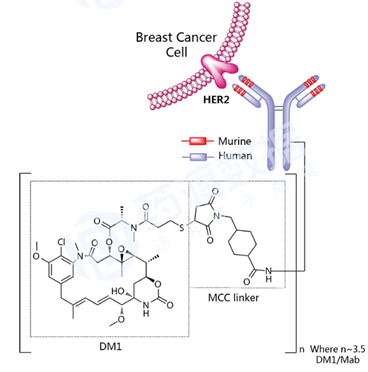
Ado-trastuzumab emtansine(商品名Kadcyla)由基因泰克 (罗氏 的子公司)研发,2013年2月获得美国FDA批准上市,靶点为HER2 ,由三部分构成:1) 靶向HER2的曲妥珠单抗 ;2) 稳定的硫醚类连接物MCC(4-[N-maleimidomethyl] cyclohexane-1-carboxylate);3) 美登素 衍生物类型的微管抑制剂DM1。MCC-DM1复合物称之为emtansine。药物抗体比率DAR平均值为3.5。Ado-trastuzumab emtansine通过抑制HER2信号通路 和破坏微管网络诱导细胞周期停止和凋亡。适应症为HER2阳性且之前至少接受过曲妥珠单抗、taxane单独或联合治疗的转移性乳腺癌 。 图6 Ado-trastuzumab emtansine结构式,来源:药渡数据库
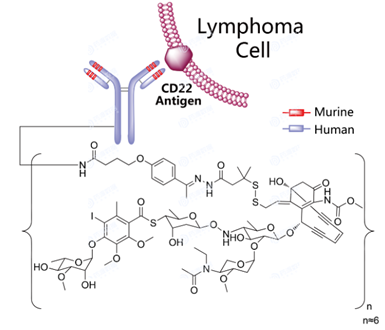
Inotuzumab Ozogamicin(商品名Besponsa EMA )批准上市,2017年8月获美国FDA批准上市,靶点为CD22,由三部分组成:1)重组人源化IgG4 kappa型单抗Inotuzumab;2)可引起胞内双链DNA断裂的N-乙酰-γ-卡里奇霉素(N-acetyl-gamma-calicheamicin);3)酸不稳定性的可裂解型 linker分子,即由 4-(4-acetylphenoxy)-butanoic acid (AcBut) 和3-methyl-3-mercaptobutanehydrazide (也称为dimethylhydrazide) 形成的缩合物。linker分子将载荷N-乙酰-γ-卡里奇霉素偶联到单抗上,每个单抗的平均有效载荷为6个,分布范围为2~8个。当Inotuzumab Ozogamicin结合于B细胞上的CD22抗原时,它被内化至细胞,其中的细胞毒性剂被释放从而破坏细胞。适应症为单一疗法用于治疗成人的复发或难治性CD22阳性的B细胞前体急性淋巴细胞白血病 (ALL ),适用于至少接受过一种酪氨酸激酶抑制剂 (TKI )治疗失败的患有费城染色体阳性(Ph +)的复发性或难治的B细胞前体急性淋巴白血病(ALL)的成人患者。 图7 Inotuzumab Ozogamicin结构式,来源:药渡数据库
第三代药物的关键是位点特异性结合,可确保具有明确DAR的抗体偶联药物 ,另外在抗体优化,连接物,结合小分子药物方面可以显著改善ADC药物的治疗作用。代表药物分别是Polatuzumab vedotin deruxtecan 。通过小分子药物与单抗特异性结合,从而开发DAR值为2或4的抗体偶联药物,没有增加药物毒性和未结合的单抗,显著改善药物的稳定性和药代动力学,增加药物活性和对具有较低抗原水平细胞的结合活性。 Polatuzumab vedotin(商品名,Polivy 基因泰克 利妥昔单抗 联合使用,用于治疗难治的弥漫性大B细胞淋巴瘤 成人患者。 图8 Inotuzumab Ozogamicin结构式,来源:药渡数据库
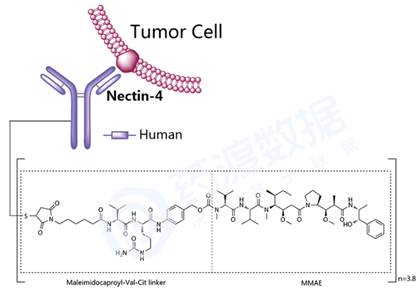
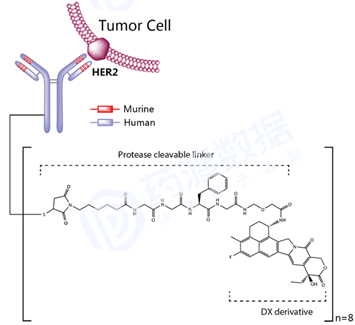
Enfortumab vedotin(商品名,Padcev)由Agensys(安斯泰来的子公司)和Seattle Genetics共同研发, 2019年12月获美国FDA批准上市。靶点为结合素4(NECTIN4),Enfortumab vedotin由三部分组成:1)重组全人源IgG1 kappa型单抗enfortumab;2)可裂解型mc-val-cit-PABC的Linker分子,即maleimidocaproyl-valyl-citrullinyl-p-aminobenzyloxycarbonyl型;3)小分子药物MMAE,一甲基澳瑞他汀 E。MMAE通过Linker偶联到单抗的半胱氨酰上,药物单抗比率DAR平均为3.8:1。被批准用于既往接受过PD -1或PD-L1 抑制剂和含铂化疗的局部晚期或转移性尿路上皮癌 的成人患者。 图9 Enfortumab vedotin结构式,来源:药渡数据库 Fam-trastuzumab deruxtecan(商品名,Enhertu),2019年12月获美国FDA批准上市,由第一三共 开发。Fam-trastuzumab deruxtecan是一种靶向于HER2的抗体偶联药物,由三部分构成:1)重组人源化IgG1 kappa型抗HER2单克隆抗体trastuzumab;2)组织蛋白酶B可裂解的四肽GGFG分子型Linker;3)有效负载为拓扑异构酶I抑制作用的喜树碱衍生物。有效负载通过linker偶联到单抗的半胱氨酰上,平均 DAR值为8。被批准用于既往接受至少2种抗HER2治疗的不可切除或转移性HER2阳性乳腺癌成人患者的治疗。 图10 Fam-trastuzumab deruxtecan结构式,来源:药渡数据库
数据来源:药渡数据库,药渡咨询整理分析
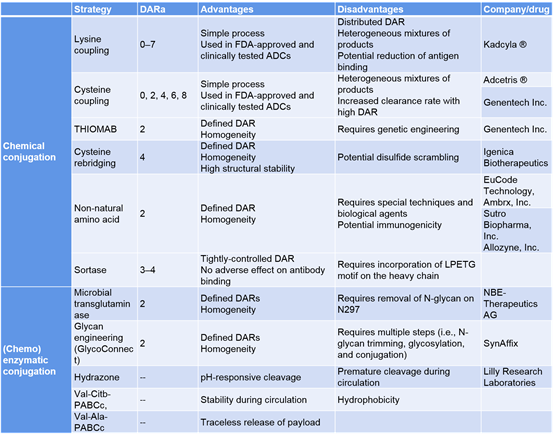
当前ADC开发领域火热非常,2019年FDA批准上市3款ADC药物,这与ADC抗体靶标范围拓展,linker技术优化以及payloads创新开发等三个领域的进展紧密相关。 ADC技术发展的难点在于linker技术。传统的linker技术一般通过将抗体链间二硫键还原,将payloads偶联至半胱氨酸或赖氨酸上。赖氨酸偶联会导致每个抗体偶联0-8个药物分子,肽图实验显示偶联位点一般发生在重链和轻链的大约20个赖氨酸残基上(一个抗体上约有40个赖氨酸),因此,此种偶联方式将会产生数百万计的不同形式的ADC药物分子。另外,ADC混合物在药物分子载量和偶联位点的不同也会使异质多样性数目翻番。不同位点偶联的多样异质ADC在体内PK动力学性质也不同,后期工业化生产难度将增加,批次间样品一致性将面临非常大的生产挑战。 很多ADC技术公司纷纷开发自己独立知识产权 的位点特异的linker技术。位点特异linker技术能保证将一定数目药物分子定点偶联至抗体的特定位点,很大程度上在生产上保证药物同质性和批量生产稳定性。另外DAR值也可以精确控制在2-或4。 目前位点特异性ADC技术一般通过工程化改造半胱氨酸位点,非天然氨基酸,硒代半胱氨酸和酶(谷氨酰胺,糖工程,FGE)偶联等技术将药物分子特异偶联至靶向抗体上,位点特异性偶联技术优劣势分析和主要提供者见表3。 位点特异性ADCs技术不仅使得在不同位点进行偶联对ADC药效影响的研究成为可能,而且可以广泛应用于其他分子如核素,免疫毒素,蛋白,前体酶等分子与抗体的偶联药物开发上,大大提高这些偶联药物的治疗效果和应用。
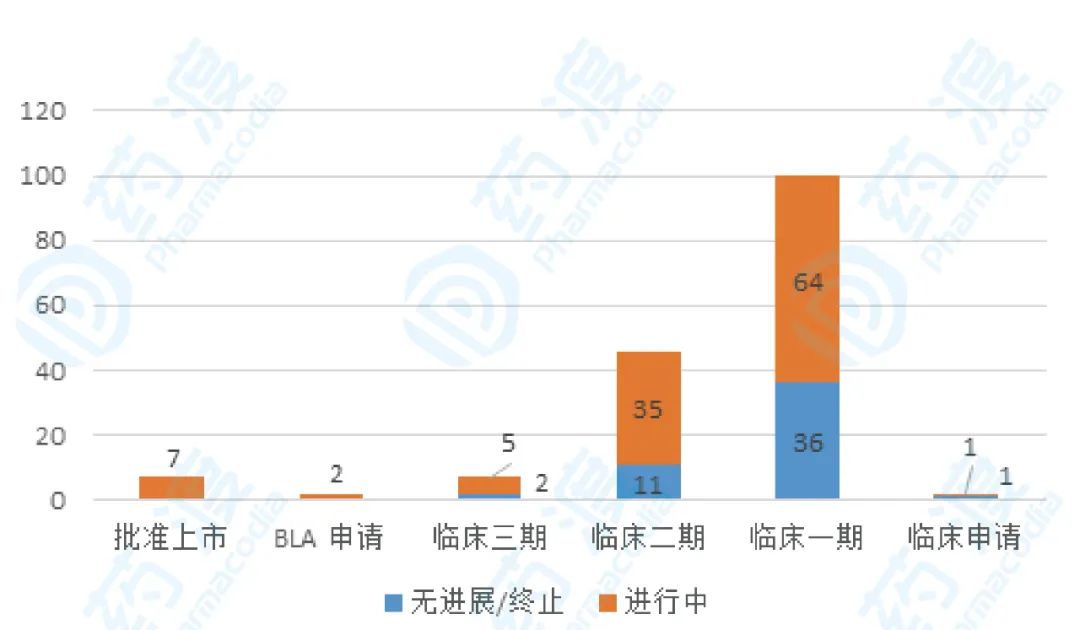
通过药渡数据库检索,进入临床阶段的ADC药物共有164项,研发状态分析结果如图12所示,大多数(n=100)处于临床一期,46项进入临床二期,7项进入临床三期,BLA申请药物有2项。
图11 全球ADC药物临床状态分布,数据来源:药渡数据库,药渡咨询整理分析
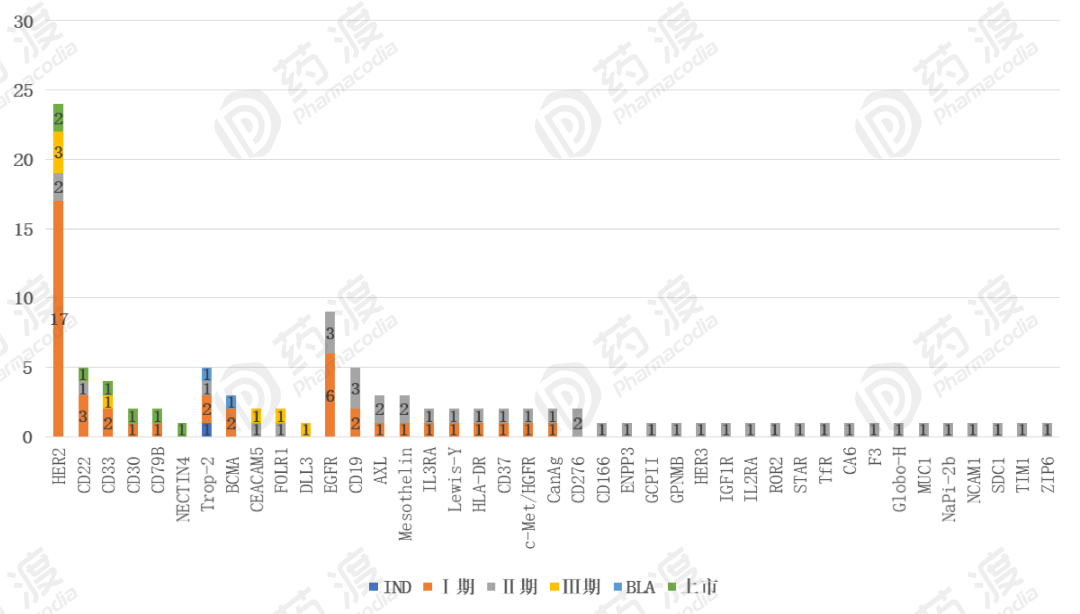
在研药物靶点分布主要集中在HER2,EGFR,CD22,CD19,Trop-2等靶点,另外一些新的靶点,比如5T4(实体瘤),Ephrin A4(实体瘤和多发性骨髓瘤 ),CD37(非霍奇金淋巴瘤 ),GPNMB(黑色素瘤 ,骨肉瘤等)也在积极开发中。 图12 ADC研发至少进入临床Ⅱ期的靶点分布
数据来源:药渡数据库,药渡咨询整理分析
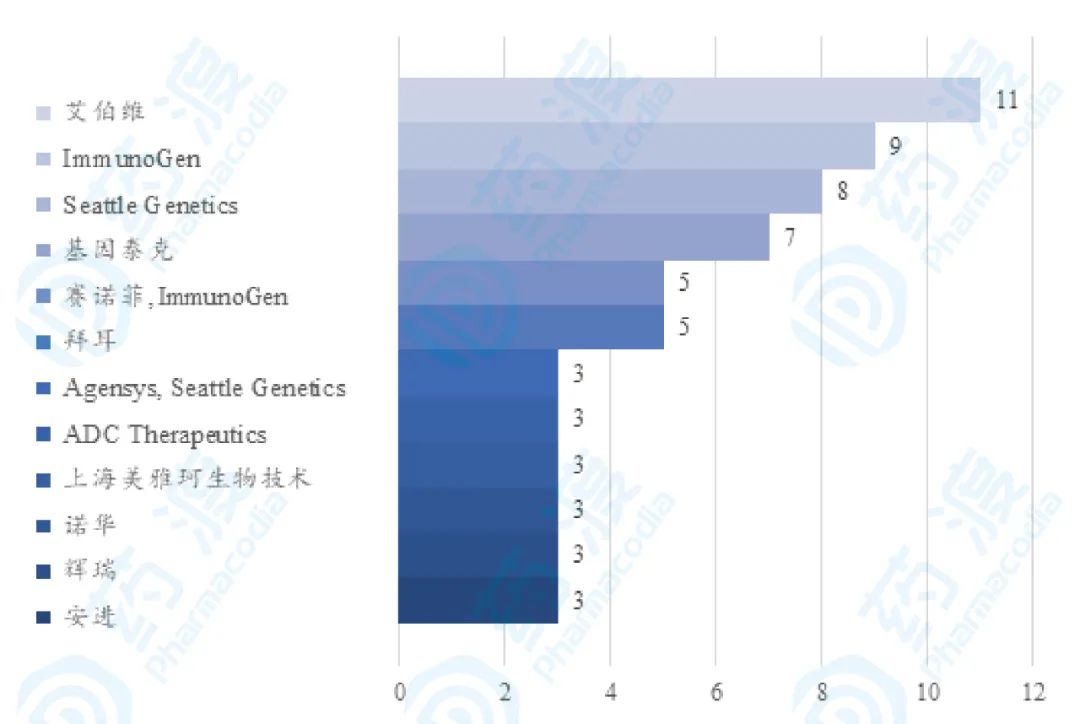
ADC药物上市或进入临床的生物医药企业至少有103家,其中主要竞争参与企业如图12,其中艾伯维 通过收购 Stemcentrx,强化肿瘤研发管线,获得3个ADC在研药物,成为拥有ADC药物管线最多的开发者。 图13 全球ADC药物研发主要竞争企业,数据来源:药渡数据库,药渡咨询整理分析
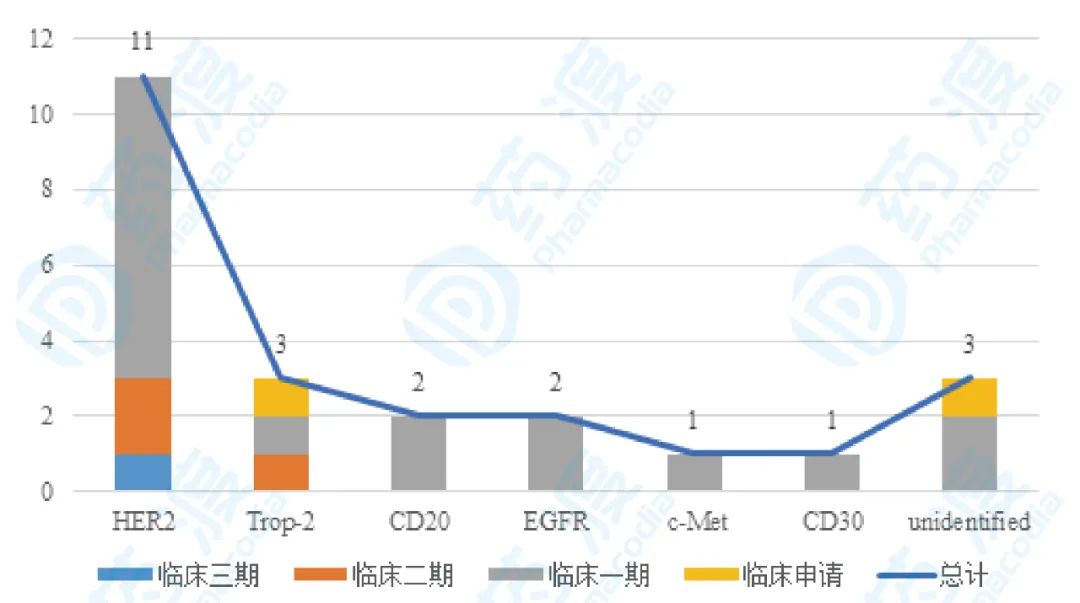
国内目前有23款产品进入临床,其中有11款是HER2靶点,适应症集中在HER2阳性乳腺癌等实体瘤,与国外靶点集中度类似。HER2成为一个验证自己平台的优选靶点,但是并不是一个值得新入局者重点推动的项目。 图14 国内ADC药物靶点和临床状态分布,数据来源:药渡数据库,药渡咨询
2019年FDA共获批3款ADC药物,是历年来获批数量最多的一年,引发关注热度。由于ADC药物利用抗原抗体的特异性,将毒性小分子药物运送到靶细胞,精准性高。与此同时,ADC的行业技术壁垒高于化学药和一般的生物药 ,经过几十年的发展,全球共上市7款药物。
根据《2020 Cortellis Drugtowatch-最值得关注的药物预测》,报告列举了11种有望在2020年上市,并预计2024全球销售额有望突破10亿美元的重磅药物,入选三款抗肿瘤药物,其中两款是ADC药物。未来一段时间,ADC药物在抗肿瘤市场将发挥巨大的潜力。 并且ADC药物设计和进一步优化还存在着很大的技术空间和强劲市场驱动力。 因文章篇幅所限,国内及国外在研品种和重要玩家并未全部展示。但是依托药渡数据库,所有数据我们已初步整理完毕。
内容仅供感兴趣的个人谨慎参考,非商用,非医用、非投资 用。版权归作者。衷心感谢! 版权声明:文中图片取自网络,根据CC0协议使用,版权归拥有者。
任何问题,请与我们联系。衷心感谢!
本文转载自药渡 ,本文观点不代表药时代DrugTimes立场。






 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
