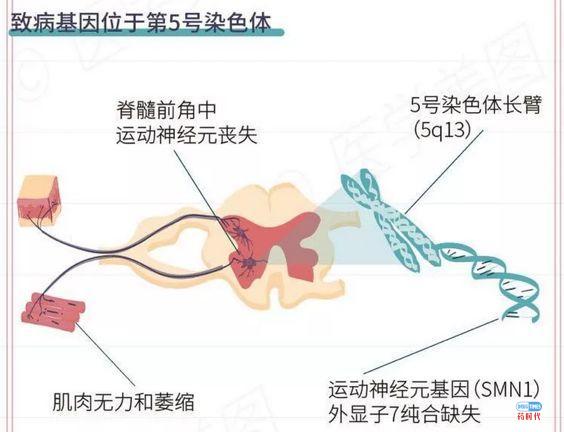
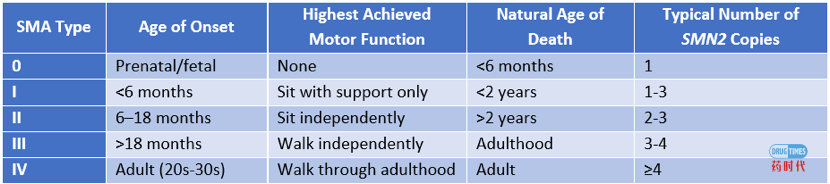
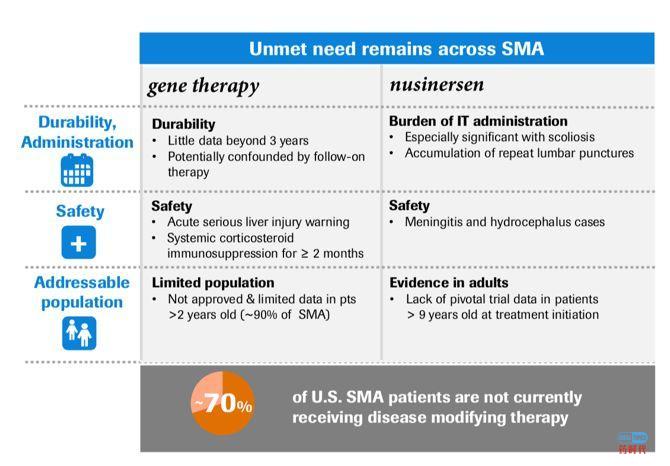
前段时间,某AAV基因治疗企业发新闻稿show几大技术平台,通篇却没有讲到底做什么适应症。找圈内人打听,说首要管线是SMA………相信各位看完下文后自有判断。
若方便请带着耳机边听《予生》,边浏览下文。

biotech公司的股价催化剂
创新药尽调漫谈
发布者:药时代,转载请首先联系contact@drugtimes.cn获得授权
前段时间,某AAV基因治疗企业发新闻稿show几大技术平台,通篇却没有讲到底做什么适应症。找圈内人打听,说首要管线是SMA………相信各位看完下文后自有判断。
若方便请带着耳机边听《予生》,边浏览下文。




发布者:药时代,转载请首先联系contact@drugtimes.cn获得授权
 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来!
