

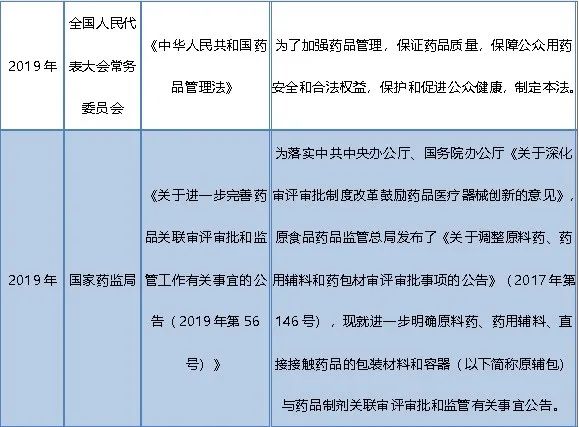
01

02
药品注册申请的类别
03





04
药品注册分类
⚪ 化学药
1类:境内外均未上市的创新药
2类:境内外均未上市的改良型新药
▲2.1类:含有用拆分或者合成等方法制得的已知活性成分的光学异构体,或者对已知活性成分成酯,或者对已知活性成分成盐(包括含有氢键或配位键的盐),或者改变已知盐类活性成分的酸根、碱基或金属元素;或者形成其他非共价键衍生物(如络合物、螯合物或包合物),且具有明显临床优势的药品。
⚪ 生物制品
参考文献:
[1] CDE官网
[2] 《药品注册管理办法》

版权声明/免责声明
本文为授权转载,不代表药时代的观点,仅供感兴趣的个人谨慎参考,非商用,非医用、非投资用。
欢迎朋友们批评指正!衷心感谢!
文中图片为授权正版图片,或来自微信公共图片库,或取自网络
根据CC0协议使用,版权归拥有者。
任何问题,请与我们联系。衷心感谢!

推荐阅读
-
特别报道 | 明星公司今何在?十年过去了,这些生物技术公司还好吗?(中) -
基石药业商业化后首份成绩单亮相:两款新药获批在即 管线2.0聚焦同类首创 -
京新药业与韩国B-PS公司达成合作,独家引进癫痫First in Class创新药 -
长效生长激素疗法获FDA批准!隆培促生长素美国率先上市 -
中国原创药企杭州奥默医药完成B轮3亿元融资! -
亚盛医药公布2021年中期业绩:重要品种临床优势突出,对外合作实现重大突破 -
CMC高峰论坛最新时间和地点:11月10-12日·上海张江博雅酒店 -
勃林格殷格翰与安立玺荣生物医药合作开发的单抗新药EI-001成功完成临床申 -
医药长子断供集采及华北制药的回应 -
原力生命完成1亿美元融资,加速肿瘤管线研发与全球化权益布局 -
中国新药研发的《觉醒年代》已经到来! -
跨国药企重大人事变动!强生CEO、安进中国总经理换人。。。 -
特别报道 | 明星公司今何在?十年过去了,这些生物技术公司还好吗?(上) -
助力中国药企出海!欧美一站式临床药品规范化管理为您服务 -
与诺同行,诺华人才空中宣讲重磅上线!即刻报名! -
辉瑞专栏 | 成功的CDMO合作如何为无菌注射产品的成功奠定基础 (第一部分,共计六部分) -
中国好BD|百奥赛图(Biocytogen) -
做药太难了!FDA也不容易!PDUFA申请费明年首次突破3百万美元 -
极目生物脉络膜上腔注射疗法ARVN001获东盟十国及印度独家权益
 点击这里,欣赏更多精彩内容!
点击这里,欣赏更多精彩内容!本篇文章来源于微信公众号:药时代
发布者:药时代,转载请首先联系contact@drugtimes.cn获得授权

 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 