寻找高质量的欧美项目?我们可以帮助您!

2020年突如其来的疫情使人们越来越重视医药行业,2021年即将到来,那么2021年第一季度有哪些重磅药物值得大家期待呢?近日,Nature Reviews Drug Discovery发布了2021年第一季度美国FDA即将批准的三款重磅药物,它们分别是治疗治疗杜氏肌营养不良(Duchenne muscular dystrophy, DMD)的casimersen,治疗边缘区淋巴瘤(marginal zone lymphoma, MZL)的umbralisib和治疗尼曼-匹克氏病(Niemann–Pick disease, NPC)的arimoclomol。
杜氏肌营养不良(DMD)是一种罕见的致命性神经肌肉遗传病,全世界每3500-5000名男性中就有一人发生。DMD的特点是进行性肌肉变性和肌无力,是由于基因突变影响肌营养不良蛋白(dystrophin)的功能而引起的。肌营养不良蛋白是一种参与维持肌肉纤维完整性的蛋白质。DMD的症状通常出现在婴幼儿身上,受影响的儿童可能会经历发育迟缓,如行走、爬楼梯或从坐姿站立困难。随着病情的发展,下肢肌肉无力蔓延到手臂、颈部等部位。大多数患者在十几岁的时候就需要全时(full-time)使用轮椅,然后逐渐丧失独立进行日常生活活动的能力,例如使用洗手间、洗澡和喂食。最终,由于呼吸肌功能不全而增加的呼吸困难需要通气支持,心功能不全会导致心力衰竭。该病是普遍致命的,患者通常在20多岁时就死于这种疾病。
casimersen是由Sarepta Therapeutics公司开发二氨基磷酸酯吗啉代寡聚物(PMOs),它通过与mRNA前体结合,改变mRNA前体的剪接过程,让生成的成熟mRNA跳过了携带基因突变的45号外显子。通常45号外显子上的基因突变导致抗肌萎缩蛋白无法生成,而casimersen疗法恢复抗肌萎缩蛋白的生成,虽然生成的蛋白缺少了45号外显子编码的氨基酸,但是它们仍然保有一定功能,所以可以减轻DMD患者的症状。

图1 通过外显子跳跃可以治疗大部分DMD患者[3]
2020年6月,Sarepta Therapeutics公司通过FDA的加速审批途径,向FDA提交了casimersen的新药申请(NDA)。NDA包含了一项名为ESSENCE的安慰剂对照III期临床研究的数据,该研究涉及43名DMD患者,此类患者的基因突变导致dystrophin基因跳过45号外显子,估计约有8%的DMD患者存在这种突变。在使用casimersen治疗48周后的中期分析显示,与基线和安慰剂相比,western blot检测的肌营养不良蛋白表达水平有统计学上的显著增加(尽管增幅不大)。
尽管对于抗肌萎缩蛋白水平的这种微小变化是否能导致临床改善还存在争议,但是之前FDA已经批准了Sarepta的PMOs疗法Vyondys 53 (golodirsen)和Exondys 51 (eteplirsen),这两款药物均是基于肌营养不良蛋白表达水平的微小变化,促进外显子跳跃,以弥补肌营养不良蛋白基因的不同突变。casimersen的NDA被接受并获得优先审查,处方药使用者收费法案(PDUFA)的生效日期指定为2021年2月25日。
拓展阅读 1、Exondys 51 (eteplirsen) eteplirsen (商品名 Exondys 51)是Sarepta Therapeutics公司研发的治疗杜兴氏肌营养不良症(DMD)的反义RNA药物,于2016年9月被美国FDA批准上市,是首个经FDA批准的用于治疗特定DMD患者的创新疗法。Exondys 51靶向抗肌萎缩蛋白mRNA前体的剪接过程,旨在引入外显子51跳跃(exon 51 skipping),生成截短但仍具有功能的抗肌萎缩蛋白。据统计,约有13%的DMD患者携带的基因突变适合外显子51跳跃疗法。 Exondys 51被批准上市,是因为其在临床试验中达到了多项生物学终点,包括正确完成外显子跳跃的RNA生成水平,抗肌萎缩蛋白的表达,及肌肉强度的增加。在上市后研究的3项实验中,无论患者处于病情发展的哪个阶段, Exondys 51都可以延缓他们肺功能的衰退。 Exondys 51被批准的使用剂量为30mg/kg,每周一次,静脉注射。一个25kg的儿童一年的使用费约为30万美元。Exondys 51在2019年销售收入3.8亿美元。 2、Vyondys 53 (golodirsen) golodirsen(商品名Vyondys 53)是Sarepta Therapeutics公司研发的治疗杜兴氏肌营养不良症(DMD)的反义RNA药物,于2019年12月被美国FDA加速批准上市,是第二款经FDA批准的用于治疗特定DMD患者的创新疗法。Vyondys 53治疗适于使用外显子53跳跃(exon 53 skipping)治疗的杜兴氏肌营养不良症(DMD)患者。Vyondys 53靶向抗肌萎缩蛋白mRNA前体的剪接过程,引入外显子53跳跃,旨在产出截短但仍具有功能的抗肌萎缩蛋白。据统计,约有8%的DMD患者携带的基因突变适合外显子53跳跃疗法。这款疗法获得FDA授予的快速通道资格,孤儿药资格和优先审评资格。 Vyondys 53的疗效在一项包括两部分的临床研究中得到评估。第一部分包括12名DMD患者,8名患者接受Vyondys 53的治疗,4名接受安慰剂治疗。第二部分为开放标签试验,包括第一部分的12名患者和13名新的DMD患者。在这项研究中,接受>48周治疗后,患者平均肌萎缩蛋白水平从正常水平的0.1%(基线)提高的正常水平的1.02%。 Exondys 51被批准的使用剂量为30mg/kg,每周一次,静脉注射。Vyondys 53的价格与Exondys 51相同。
边缘区淋巴瘤(MZL)是一组缓慢生长的成熟B细胞非霍奇金淋巴瘤(NHL)。MZL通常被认为是一种慢性不治之症,在美国,MZL是第三大最常见的B细胞NHL,约占所有NHL病例的8%。滤泡性淋巴瘤(FL)是一种起源于B淋巴细胞的非霍奇金淋巴瘤(NHL),FL是最常见的惰性淋巴瘤,约占所有NHL病例的20%。
TG Therapeutics公司开发的umbralisib是一款每日口服一次的新一代PI3Kδ和CK1ε的小分子抑制剂。它对PI3Kδ的特异性优于其它PI3Kδ抑制剂,不会对PI3γ产生抑制。而且它能够通过抑制名为CK1ε的蛋白,防止扰乱调节性T细胞的功能,从而提高药物的耐受性。它曾经获得FDA的突破性疗法认定,治疗边缘区淋巴瘤患者。
2020年1月,TG Therapeutics公司向FDA提交由unil –NHL临床试验支持的NDA,这是一项II/III期试验,涉及200多名接受过至少两种前期治疗的NHL患者。该试验在两组患者中达到了总有效率的主要终点40-50%的目标,一组纳入了复发/难治性MZL患者,另一组纳入了三线或更晚的滤泡性淋巴瘤(FL)患者。MZL组的总有效率为49%,完全有效率为16%,FL组的总有效率为45%,完全有效率为5%。
2019年1月,umbralisib获得了MZL的突破性治疗指定,并于2020年8月针对MZL患者的umbralisib NDA被优先审查,PDUFA目标日期为2021年2月15日。FL的NDA被授予标准审查,PDUFA目标日期为2021年6月15日。
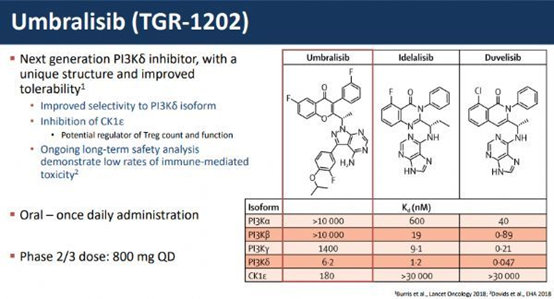
图2 umbralisib概况[4]
尼曼-匹克氏病(Niemann–Pick disease, NPC)又称鞘磷脂沉积病,属先天性糖脂代谢性疾病,为常染色体隐性遗传疾病。NPC因为NPC1或NPC2基因变异导致鞘磷脂无法及时从细胞内转移造成蓄积、进而引起组织损伤,其特点是全单核巨噬细胞和神经系统有大量的含有神经鞘磷脂的泡沫细胞。在美国,尚无FDA批准的NPC治疗药物。如果获得批准,arimoclomol将成为第一个治疗NPC的药物。在欧洲,Zavesca(miglustat,麦格司他)于2009年获得批准,是唯一治疗NPC的药物。在中国,miglustat已于2017年批准上市,商品名为泽维可(麦格司他胶囊),用于成人及儿童NPC患者的进行性神经症状的治疗。
arimoclomol是Orphazyme公司的小分子化合物,该药是一种小分子热休克应激反应诱导剂,可诱导增强热休克蛋白(HSP)的表达。arimoclomol口服后能快速分散到全身,并可穿过血脑屏障,进入大脑。该药通过刺激细胞自身的热休克反应在应激细胞中发挥作用,帮助错误折叠的蛋白质恢复正常功能,或者在无法恢复正常功能时利用细胞的回收系统——溶酶体,将这些蛋白回收,使其不再形成有毒性的聚积物,这将有助于减少错误折叠蛋白质的累积,而这些蛋白质可能是导致多种疾病和症状的原因。
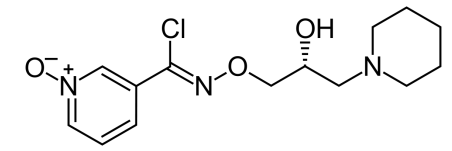
图3 arimoclomol分子结构式[5]
来自关键II/III期随机安慰剂对照试验(CT-ORZY-NPC-002)的数据表明,arimoclomol在稳定NPC神经系统进展方面具有积极作用,特别是≥4岁患者亚组以及接受miglustat(麦格司他)作为常规临床护理的患者亚组中。治疗2年期间,arimoclomol对疾病进展表现出持续改善作用。此外,最初随机分配接受安慰剂的患者,在转向arimoclomol治疗后,病情进展减少了90%。FDA将PDUFA的目标日期定在2021年3月17日。
参考文献:
[1] https://doi.org/10.1038/d41573-020-00216-8
[2]新浪医药新闻
[3] Sarepta Therapeutics公司官网
[4] https://doi.org/10.1016/S1470-2045(18)30082-2
[5] Wikipedia

药时代,我们帮您找到理想的新药合作伙伴!


 点击阅读原文,把握更多价值资讯!
点击阅读原文,把握更多价值资讯!发布者:药时代,转载请首先联系contact@drugtimes.cn获得授权


 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
