本文作为小甜点,翻译了一篇着重结构和临床试验统计的双抗综述。文献只整理了2018.9.5之前的双抗临床统计试验,因此,我们自己整理并添加了2018.9.5之后截止到2019.8.15最新的临床试验。
获取原文和临床试验统计数据,关注公众号,对话框输入“bsAbs”。
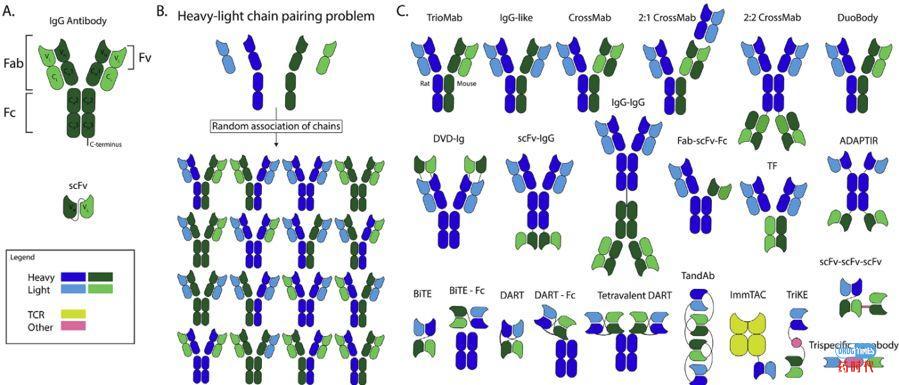
生物技术的进步导致抗体生产和重组技术的改进,推动了抗体和无数抗体结构的开发。目前,美国食品和药物管理局(FDA)批准了72种抗体,其中30种已注册用于治疗癌症患者。抗体在癌症治疗中发挥着越来越重要的作用。对于抗体以及如何改变它们的药代动力学和物理化学性质的理解不断深入。在抗体作为标准治疗方法建立后,越来越复杂的抗体结构被开发出来。除了完整的免疫球蛋白G (IgG)抗体、首个抗体药物偶联物和双特异性抗体(bsAb)已被批准用于治疗癌症患者,其他一些抗体结构药物正处于临床试验中(图1)。

图1.目前在临床试验中评估的抗体结构和bsAb结构示意图。(A)IgG抗体结构由Fab和Fc区组成。该Fab区的结合部分称为单链可变片段(scFv)。抗体存在两条重链(VH和CH)和两条轻链(VL和CL)。这些重轻链可以通过可变区(VH和VL)和恒定区(CH和CL)进行细分。(B)随机重- 轻链配对可能产生的不同组合。(C)目前已批准或正在临床试验中的双特异性抗体结构
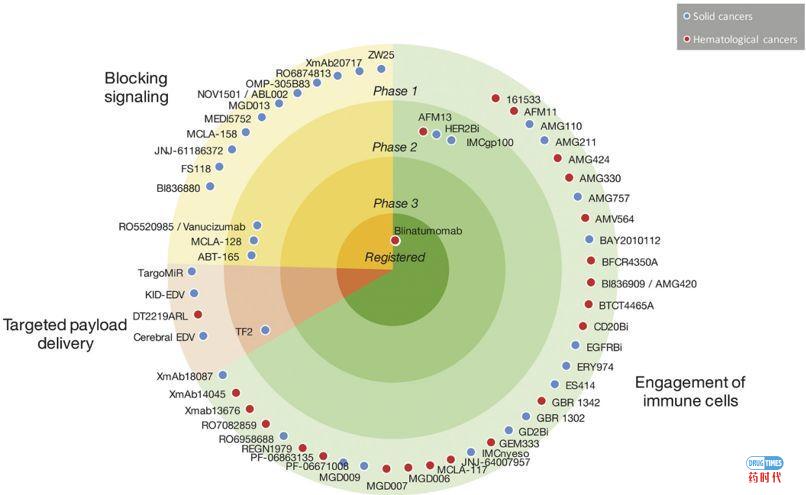
标准的人体抗体是一种专一性抗体,它的两个结合位点都针对同一靶标。bsAb是一个更为复杂的结构,其结合位点针对不同的作用靶标。这使其能够实现一些新颖独特的作用机制,如使免疫细胞参与杀伤肿瘤细胞,向肿瘤细胞递送有效载荷,或者阻断肿瘤细胞重要的信号通路(图2)。每一种作用机制都需要通过修饰bsAb获得理想的药代动力学特性。关于这些bsAb结构及其作用机制已经发表了大量的临床前研究数据。
图2.在肿瘤学临床试验中提出的双特异性抗体(bsAbs)作用机制的简化示意图。1.免疫细胞与肿瘤细胞的结合。免疫细胞可以与肿瘤细胞结合。2.靶向性递送有效载荷。用对肿瘤和有效载荷都具有亲和力的bsAb靶向肿瘤细胞。3.阻断信号。bsAb阻断两个信号。
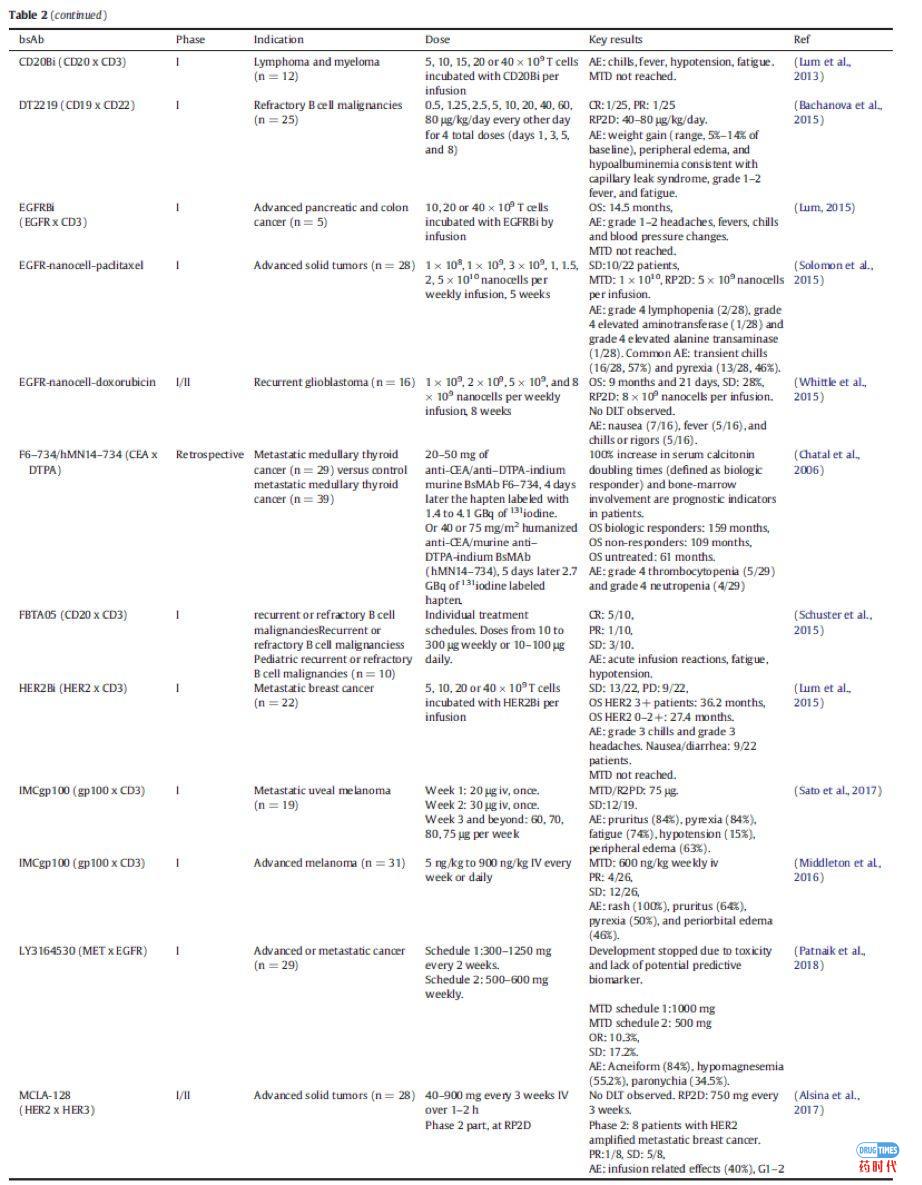
在肿瘤学领域,已有两种双特异性抗体(bsAbs)被批准用于临床。Catumaxomab靶向上皮细胞黏附分子(EpCAM)和CD3, 2009年被欧洲药物管理局(EMA)批准用于治疗恶性腹水。然而,应MAH的要求,Catumaxomab的市场授权于2017年6月撤销。Blinatumomab是靶向CD19和CD3的双特异性抗体,于2014年12月获FDA批准,2015年12月获EMA批准用于治疗费城染色体阴性B细胞急性淋巴细胞白血病(ALL) 。在肿瘤之外,结合凝血因子IXa和X的bsAb emicizumab于2017年11月被FDA批准,并于2018年3月被EMA批准用于治疗血友病A。
目前,包括blinatumomab在内的57种bsAbs正在用于癌症患者的临床试验中,其中38种使用相同的作用机制:促进免疫细胞与肿瘤细胞的结合。在剩下的19个进行临床试验的bsAbs中,5个双特异抗体的作用机制是向肿瘤递送有效载荷,14个双特异性抗体的作用机制是阻断癌症微环境中的信号通路。
1)通过总结bsAbs的肿瘤临床开发来评估双特异抗体的结构选择;
2)明确双特异性抗体在肿瘤临床开发中所面临的挑战。
单抗的两个结合区域针对同一表位。因此,单抗是双价且具有靶标单一性。相反,bsAbs具有能结合两个不同的靶标的表位,根据其结构的不同,可以是单价的,也可以是双价的。
单抗通常由杂交瘤细胞系表达,杂交瘤细胞系是分泌抗体的B细胞和永生的骨髓瘤细胞系的融合体。BsAbs可以通过融合两个杂交瘤细胞系而产生,其结果是产生IgG分子的混合物。此外双抗还可以通过组合两种现有抗体或它们的片段来产生。另一种因其灵活性而广受欢迎的选择是使用重组蛋白。使用遗传工程化重组蛋白质创造了关于起源组成和生产系统。例如,这些蛋白质可以用来控制重链和轻链的结合。基本的bsAb结构包括来自一种抗体的重轻链对和来自另一种抗体的重轻链对。当这四个单独的链结合在一起时,它们随机结合,可以产生16种IgG分子的组合。其中的两种组合产生了所需的bsAbs结构,其异质二聚重链与来自同一抗体的特定轻链结合(图1B)。嵌合四聚体、常见的轻链和重组蛋白可以通过限制缔合的选择来提供解决方案。嵌合四聚体具有受物种限制的重-轻链配对。此外,使用普通的轻链也可以防止不必要的重轻链组合。重组蛋白可以通过多种途径促进重轻链与重链的正确结合。
例如,孔内旋钮方法,其中一个重链是由一个由相对较大的氨基酸组成的旋钮设计的,而另一个重链是由一个由相对较小的氨基酸组成的孔设计的。其他的例子是由肽链连接片段的结构,例如双特异性T细胞衔接器(BiTE)分子,从而绕过链的随机关联。
就像抗体一样,bsAb可以通过无数种方式进行修饰,自定义其功能,增强其功效,如调节抗体的免疫原性、效应函数和半衰期。
关于调节免疫原性的问题,抗体结构中来源于小鼠的能产生免疫原性的结构常常被人类的相同结构替代,以降低自身免疫原性。这导致了嵌合人源化抗体结构的产生。越来越多的全人源化抗体生产出来,通常是通过噬菌体展示或产生人类IgG的转基因小鼠。利用噬菌体展示,筛选表达抗体部分的噬菌体文库,以确定其与抗原的亲和力。其他能够引起免疫原性的抗体结构的部分是外来氨基酸序列,可能是由新的蛋白质工程引入的。
关于抗体的效应功能,Fc区域在介导这一过程中起着重要作用。该区域参与免疫介导的细胞杀伤机制,如补体依赖的细胞毒性和抗体依赖的细胞毒性。与靶向肿瘤细胞的抗体不同的是,结合免疫细胞的抗体被设计用来减轻这种细胞杀伤作用。肿瘤细胞靶向抗体需要一个功能Fc区域来杀死目标细胞。
糖工程和改变Fc区氨基酸序列可以影响免疫介导的细胞杀伤机制。这些技术可以通过抗体增强或减少免疫介导的细胞杀伤,这取决于修饰抗体的聚糖和氨基酸的位置和功能。除了消除通过免疫介导的细胞杀伤,整个Fc区域也可以被删除,从而区分出带有Fc区域的抗体和缺乏Fc区域的抗体。这种去除Fc的抗体的分子量大大降低,进而影响了抗体的药物动力学特性,包括抗体清除和肿瘤穿透性。
完整的IgG抗体大小约为150 kDa,由肝脏清除,而分子量低于60 kDa的蛋白质则由肾脏清除。肾清除比肝清除快。抗体的大小也可以通过移除Fab中非结合区域CL和CH1区域。如果从结构中删除非结合区域,则只保留必要的结合区域,即可变区片段。这些由一个单一的肽链连接在一起的可变区片段称为单链可变片段(scFv) 。由于ScFvs体积小且缺乏新生儿受体,因此可以迅速从体内循环中清除。因此,当患者治疗时为了保持一个恒定的血药浓度,必须持续使用scFvs。此外,scfv可以作为构建单元来创建bsAbs(图1C)。
除了增加抗体结构的大小,其他延长抗体半衰期的方法包括与白蛋白融合或与白蛋白结合、与聚乙二醇片段结合以及融合Fc。几种双特异性结构与人血清白蛋白融合后,在小鼠模型中增加了半衰期。此外,在双特异性抗体中添加Fc区域可以避免由于快速清除而需要对小型抗体进行连续给药。在非人类灵长类动物中,通过融合Fc区域,将不同BiTEs的血清半衰期从6 h延长到44-167 h 。
双特异性抗体和标准单抗的差别在于双抗主要作用于两个不同的靶标。二价结合增加了抗体活性,并可影响其药效学。双价抗体可诱导抗体依赖的二聚化,其中一个例子是一种可以阻断间充质上皮转化因子(MET)激酶信号。当然,经过改造的单价抗体也可以阻断MET受体的二聚化和下游信号的激活。
以CD3为靶点的二价抗体会诱导T细胞间的交联,导致T细胞裂解。但是,靶向CD3的单价抗体在体外却不会诱导T细胞裂解。为防止接受肾移植的患者出现排斥反应,一种靶向CD3的二价抗体可以发挥耗尽T细胞的作用,但是也会引起严重的细胞因子反应。而用于肿瘤治疗的能招募免疫细胞参与的bsAbs主要依赖于免疫细胞,发挥抗肿瘤作用因而要避免免疫细胞衰竭,所以这类bsAbs大都用单价抗体和CD3结合。
对癌症免疫治疗兴趣的日益增长推动了招募免疫细胞的bsAbs的发展。bsAb blinatumomab使免疫细胞与ALL病人的B细胞结合。它能招募表达CD3抗原的T细胞,CD3抗原是T细胞的一般标记物。T细胞通过靶向肿瘤相关抗原(TAA)与肿瘤结合。对于blinatumomab来说,TAA是CD19,CD19是B细胞的一种标志物。一般情况下,TAA应该是针对肿瘤细胞的,使健康组织不受伤害。TAA并不一定在癌症的发病机制中起作用;其主要作用是在在免疫细胞参与的情况下,在肿瘤细胞膜上提供一个能够结合的位点。
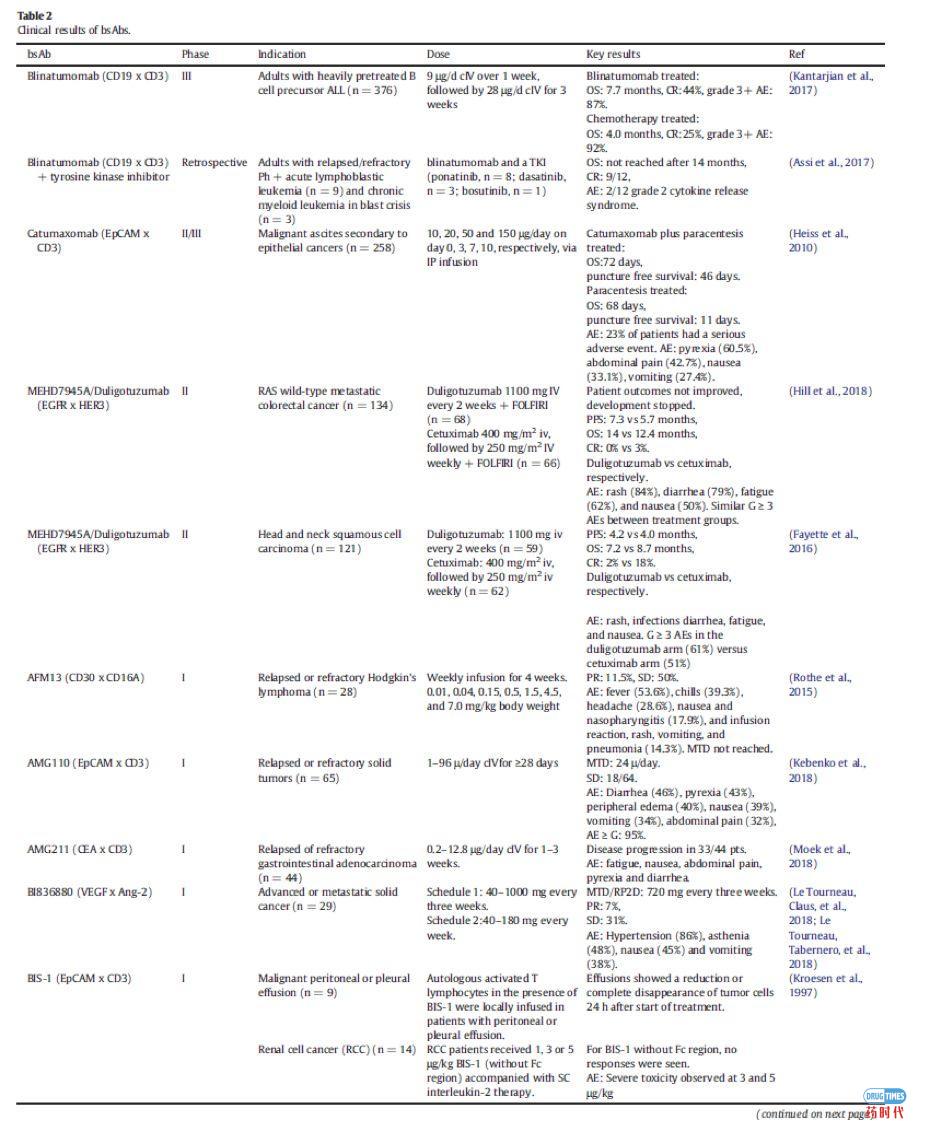
免疫细胞参与bsAbs的应用已经探索了30多年。最近,blinatumomab证实了免疫细胞参与的bsAbs治疗血液学恶性肿瘤的潜力。在一项随机研究中,ALL(heavily pretreated B cell precursor)患者均使用blinatumomab单抗治疗,中位生存时间为7.7个月,而化疗治疗组的中位生存时间为4.0个月(表2)。大多数临床试验中的bsAbs都是招募免疫细胞参与的;在ClinicalTrials.gov上报道的57例肿瘤相关的bsAbs中,有38例属于这种类型(图3)。
在进行肿瘤临床试验的38种通过招募免疫细胞发挥作用的双特异性抗体中,有36种是通过与T细胞受体CD3结合招募T细胞发挥抗肿瘤作用,在这些双特异性抗体中有18种针对恶性血液瘤的靶点,16种以实体瘤为靶点。
当T细胞和肿瘤细胞都被bsAb结合时,就形成了一个溶细胞突触。在这个细胞水解突触中,T细胞释放穿孔素和细胞毒性颗粒酶-b,导致靶细胞死亡,这一机理已在体外得到证实,并已通过共聚焦显微镜观察到。在没有靶细胞的情况下与T细胞结合并不会激活T细胞,这与体外用人外周血单核细胞(PBMCs)和BITE进行的T细胞活化和细胞毒性试验结果一致。
然而,当表皮生长因子受体(EGFR)阳性和阴性的癌细胞在体外混合并用于建立人类异种移植小鼠模型时,结合CD3和EGFR的BITE也会导致EGFR阴性细胞的死亡。这说明BITE治疗也能引起非TAA表达肿瘤细胞的杀伤。
临床前研究表明,免疫检查点参与缓解了血液病患者对招募免疫细胞的bsAbs的反应。将以CD33和CD3为靶点的BITE结构双抗AMG330加入到从患者收集的原发性急性髓系白血病(AML)细胞和PBMCs的共培养中,促进了以AML细胞为主的程序性死亡配体1 (PD-L1)表达的上调(Krupka et al.,2016)。在这些患者样本中添加抗pd -1和/或抗pd – L1抗体可增强双抗对AML细胞的杀伤。在食蟹猴中, 采用靶向全长CD3和B细胞谱系标记物FcRH5的bsAb治疗多发性骨髓瘤,检测到血、脾、淋巴结和骨的PD1 + CD8+ T细胞增加及B细胞的消除。将该bsAb在体外与抗PD-L1抗体联用,可以增加转染PD-L1编码质粒的肿瘤细胞的裂解。
在许多具有功能免疫系统的实体瘤小鼠模型中,已经观察到免疫细胞参与的bsAbs对肿瘤的反应。在这些研究中,选择了广泛的TAAs,包括已建立的肿瘤标志物,如癌胚抗原(CEA)、EpCAM、人表皮生长因子受体2 (HER2)和EGFR。然而,关于免疫细胞参与的bsAbs在人类实体瘤中的临床疗效数据却很少。
一个值得一提的例子是双特异性抗体IMCgp100,它能结合CD3及黑色素瘤相关抗原糖蛋白-100 (gp100)。IMCgp100的双特异性抗体ImmTAC以T细胞受体(TCR)而不是抗体的Fab区域作为表面蛋白gp100的靶点。TCRs的使用能够靶向主要组织相容性复合体分子所表达的细胞内癌蛋白。然而,多克隆T细胞的反应,如cd3参与的bsAbs所产生的反应,被排除在外。针对细胞内wt1蛋白的特异性TCR与靶向CD3的scFv结构的双特异性抗体,在人类白血病和实体癌的异种移植小鼠模型显示了疗效。
一种稍微不同的方法是使用武装了T细胞的bsAb。HER2Bi就是一个例子,它是一种bsAb,由靶向HER2和CD3的两个连接抗体组成。在一期研究中,从患者身上提取T细胞,与bsAb一起培养。然后将T细胞和bsAb重新注入病人体内。由于离体环境中与T细胞结合的条件可控,bsAb的潜在需求更少,副作用的几率可能会降低。一期临床研究证实了相对温和的副作用,并显示出通常参与抗肿瘤免疫应答的细胞因子增加水平(表2)。

图3.正在开发中并在ClinicalTrials.gov网站上注册了癌症患者的临床试验的BsAbs。BsAbs显示为点,它们在图表中的位置表示开发的阶段及其作用机制。注册的bsAbs都显示在图表的中心,处于临床1期的bsAbs显示在外围。bsAbs也按照作用机制进行分类:绿色部分表示有免疫细胞的参与的双抗,红色部分表示靶向bsAbs,黄色部分表示具有信号阻断的双抗。点的颜色表示bsAb是针对实体瘤还是血液瘤。



4.2招募CD3+ T细胞参与的bsAbs与免疫系统的相互作用
一般来说,动员T细胞的bsAbs破坏其靶细胞是独立于共刺激信号之外的,如在体外细胞毒性试验中,在抗cd3×抗cd19 bsAb存在的情况下,人PBMCs诱导人淋巴瘤细胞系的死亡。然而,添加一种共刺激信号,例如白细胞介素-2,可以增强效力,特别是当PBMC与共刺激信号共培养时。同样,靶向共刺激分子CD137和CD28作为一种联合治疗,可以改善招募免疫细胞的bsAbs的杀伤肿瘤细胞作用。将抗cd137和抗cd20的双抗与抗cd3和抗cd20的双抗联用,在携带人类淋巴瘤异种移植瘤的小鼠中显示出协同作用。然而,单独使用CD137×CD3 bsAb并不能降低肿瘤的生长。
除了共刺激分子,共抑制分子也被认为阻碍了招募免疫细胞参与的bsAbs的作用。BsAb RO6958688,以CEA和CD3为靶点的2:1 CrossMab结构的双抗,在与PBMCs联合移植的小鼠体内增加了T细胞向异种移植结肠癌的浸润。此外,给予该bsAb可将PD-L1阴性肿瘤转化为PD-L1阳性肿瘤。同样的结果也出现在了使用ERY974(一个针对glypican-3和CD3的IgG形式的bsAb)治疗移植了转染人类糖皮质激素-3的肺癌和肝癌细胞的表达人类CD3转基因小鼠肿瘤模型。在T细胞和一组肿瘤细胞系的体外共培养中,无论初始表达水平如何,靶向CD3和CEA的BiTE均可诱导T细胞上的PD1表达和肿瘤细胞上的PD-L1表达。抗pd1和抗pd – L1抗体的加入增强了BITE抗体的活性。
在体外实验中,HER2-TBD一种抗her2 x抗cd3的bsAb对转染PD-L1的HEK293肿瘤细胞的杀伤活性降低。在该研究中,给予该bsAb联合PD-L1阻断抗体可恢复bsAb的细胞毒性潜能。接下来,在表达人CD3的转基因小鼠的同源肿瘤模型中,单独使用抗her2 x抗CD3 bsAb或联合抗pd -L1抗体使用,作用于转染的人her2的CT26肿瘤。联合治疗也能更有效地控制肿瘤生长。结合CD3与TROP-2靶点的Fab(2)-scFv双抗联合抗pd1抗体在MDA-MB-231乳腺癌细胞株小鼠体内异种移植瘤模型中显示了协同作用。
潜在的免疫细胞参与的bsAbs提高了T细胞对实体肿瘤的渗透作用,最新的证据表明抑制PD1 / PD-L1轴可以加强bsAbs的作用,这些结果促使了在I期临床试验中评估招募免疫细胞参与的bsAbs联合检查点抑制剂的疗效,特别是和anti-PD-L1抗体联用的效果(表3)。
RO6958688是一种针对CEA和CD3的bsAb,联合抗pdl1抗体atezolizumab治疗转移性结直肠癌临床结果显示了联用具有增强活性的效果。单独用RO6958688治疗的31名患者中有2名患者部分反应,而组合治疗组的14名患者中有3名患者部分反应,未发现额外增加的毒性。
除T细胞外,其他效应细胞或免疫细胞亚群也可参与肿瘤细胞的作用。有许多CD3 + T细胞亚型,并不是所有的都有助于抗肿瘤免疫反应。调节性T细胞(Treg)抑制活化的T细胞。42例B细胞ALL患者在blinatumomab单抗治疗前外周血中treg的含量与治疗反应呈负相关。在体外,blinatumomab激活了抑制效应T细胞细胞毒性的Tregs 。阻止Tregs的活化是CD8+ T细胞与前列腺干细胞抗原串联结合的scFv结构双抗背后的理论之一。这种bsAb确实在体外诱导了人前列腺肿瘤细胞株的裂解,但与CD3+ T细胞与人PBMCs和分离的CD8+ T细胞共培养时相比,bsAb的裂解效果较差。
具有作用于T细胞受体CD28与CD20的bsAb在体外的几种淋巴瘤细胞株和PBMCs共培养体系里面显示了强劲的杀伤肿瘤细胞的作用。BITE样结构双抗RM28以CD28和TAA黑色素瘤相关蛋白聚糖为靶点,作用于黑色素瘤细胞。在2007年完成的一期临床试验中,这种bsAb被用于转移性黑色素瘤患者的肿瘤内治疗(NCT00204594),但结果尚不清楚。
BsAbs也被开发用于靶向自然杀伤细胞(NK),这是一种天然免疫系统的强细胞毒性淋巴细胞。一项针对AFM13霍奇金淋巴瘤患者的一期试验已经完成,这是一种针对CD30和CD16的串联diabody (TandAb)结构。在该研究中,外周血NK细胞活化,可溶性cd30降低,26例患者中有3例出现部分缓解(Rothe et al.,2015)(表2)。
通过在抗CD33和抗CD16结构之间引入IL-15修饰的bsAb结构(图1C) 与未修饰的bsAb相比,它具有更好的体外抗肿瘤活性,提高了人NK细胞的存活率。目前计划对CD33+髓系恶性肿瘤患者进行一项三特异性结构161,533的试验(表S1)。
BsAbs也是有效载荷递送的载体。目前放射免疫治疗和抗体-药物偶联物等抗体已经进入临床。在这种方法中,含有同位素或药物的有效载荷直接与抗体耦合。90Y-ibritumomab tiuxetan注册用于治疗非霍奇金淋巴瘤,曲妥珠单抗抗体偶联物(ado-trastuzumab emtansine)注册用于治疗转移性乳腺癌HER2 过表达的患者,brentuximab vedotin登记治疗霍奇金淋巴瘤和系统性的间变性大细胞淋巴瘤。它们通过将抗体与TAA结合,将有效载荷直接递送到肿瘤细胞,带有有效载荷的抗体,与TAA结合,然后被内在化,有效载荷在细胞内释放并发挥作用。
使用bsAb可以实现新的目标定位方法。与抗体直接偶联不同,与TAA和有效载荷有亲和力的bsAb可以在注射前与有效载荷结合。通过首先注射对TAA和有效载荷具有亲和力的bsAb,然后注入有效负载,也可以实现预定目标的传递。用于向肿瘤递送有效载荷的预靶向技术可能潜在地规避健康组织长时间暴露于有效载荷,从而减轻毒性和不良反应。连接有效载荷和bsAb是通过将bsAb的一只手臂指向有效载荷的半抗原来实现的。半抗原是一种本身不具有免疫原性的分子,但可以作为抗原并与抗体结合。
1993年发表了第一篇报告使用bsAb递送有效载荷的临床试验的论文。目前,有5种bsAbs正在进行临床试验,其中4种针对实体肿瘤。BsAb TF2,有三个Fab片段,其中两个靶向CEA和一个靶向有效载荷,目前最快推进到2期临床(图3)。
表达CEA的髓样甲状腺癌患者注射bsAb TF2,靶向CEA和有效载荷。24小时后,施用有效负载,即用111铟标记的小肽。在施用该小肽后24小时观察肿瘤与组织中有效负载的比率大于1:20,显示用bsAbs预靶向的可行性。理论上,由于其体积小,未绑定的有效载荷将被迅速清除,减小了对非目标组织的损伤。
当有效载荷为治疗性放射金属时,半抗原可作为放射金属的螯合剂。另一种选择是使用两个半抗原创建一个大的双价半抗原,有利于同两个肿瘤结合的bsAbs,这将使肿瘤的结合更加稳定。该系统被称为亲和增强系统,已用于临床研究(表2)。
对于用于放射免疫疗法的预靶向递送钇-90,将CD38和DOTA-钇复合物具有亲和力的bsAb与通过链霉抗生物素蛋白- 生物素键结合放射性金属的抗体进行比较。在异种移植的非霍奇金淋巴瘤或多发性骨髓瘤小鼠中,bsAb方法显示出优于链霉亲和素生物素方法的抗肿瘤效果(Green et al.,2018)。
也可以通过连接有效载荷和抗体的替代方法实现预靶向。这些包括链霉亲和素- 生物素,寡核苷酸或click化学,如四嗪和反式环辛烯之间的环加成反应。然而,bsAbs方法是迄今为止唯一在临床中进行测试的方法(表2)。
bsAbs通过结合螯合剂半抗原,在动物模型中探索了bsAb(如阿霉素)预先靶向递送其他有毒有效载荷。在这些研究中,螯合剂被加载放射性同位素锝-99,以验证目标特异性结合。其他半抗原,如地高辛,也可以结合到有效载荷上,用于药物传递。几种有效载荷,如阿霉素和与地高辛结合的荧光染料Cy5,在人类异种移植小鼠模型中显示出特定的靶向性。
一种直接靶向的方法,即在给药前将bsAb和有效载荷孵育的方法正在进行临床实验。在这种方法中,有效载荷被封装在一个细菌衍生的纳米细胞中,称为engeneic delivery vehicle (EDV),bsAbs是通过Fc区域连接在一起的两个抗体。有效载荷可以是化疗药物,如阿霉素或紫杉醇,但也可以是microRNA。三个测试EDVs的试验结果已经公开,一期临床数据显示安全状况尚可接受。
bsAb DT2219与有效载荷直接偶联,并且靶向CD22和CD19以增强特定的递送能力。有效载荷为白喉毒素,经CD19和/或CD22内化后进入胞质。该bsAb已在难治性B细胞恶性肿瘤患者中进行研究,25例患者中有1例出现完全反应和1例出现部分反应(表2)。
用联合疗法靶向癌症的多个表位或受体是一种流行的方法,许多抗体治疗的联合方法正在临床试验中进行评估。
抗pd -1抗体nivolumab与抗ctla4抗体ipilimumab联合治疗转移性黑色素瘤已获FDA和EMA批准。最近,这种组合也被FDA批准用于治疗晚期肾细胞癌。另一种稍微不同的联合治疗是使用帕妥珠单抗和曲妥珠单抗的多表位方法,两者都以HER2为靶点,但在不同的表位上。它已被批准作为转移性her2阳性肿瘤的联合治疗。
从理论上讲,两种抗体的靶点可以合并成一个单一的bsAb,可以产生各种各样的好处。这种药物的特异性可以通过癌症受体的共同定位来增强,从而将健康组织的靶向毒性降到最低。此外,可以通过靶向一个抗原的不同表位来提高结合亲和力。这种bsAb的潜在缺点是,它将自己限制在一个固定的抗原组合,而单抗可以自由组合,可以不同顺序给药或个性化剂量给药。根据ClinicalTrials.gov网站的数据,目前正在临床试验中研究14种bsAbs,它们可以阻断重要的肿瘤信号传导。
由于不同信号之间相互作用,普通bsAbs主要干扰两个信号途径,如ErbB家族成员EGFR、HER2和HER3。
BsAbs MM-111、JNJ-61186372和MEHD7945A是针对这些目标中的一个或多个。尽管它们的半衰期都很长(表1),但是它们使用不同的结构来实现这一点。
有趣的是,针对EGFR和HER3的bsAb MEHD7945A比抗EGFR抗体西妥昔单抗或EGFR 激酶抑制剂厄洛替尼更有效,在人非小细胞肺癌和头颈部鳞癌的异种移植模型中克服了西妥昔单抗和厄洛替尼耐药。这很可能是由于阻断了ErbB家族成员的信号通路的交互作用。然而,MEHD7945A对转移性结直肠癌和头颈部鳞状细胞的2期试验中没有发现MEHD7945A优于西妥昔单抗的益处。因此,这个bsAb的开发已经停止(表2)。
正在研究的其他靶标有死亡受体,如CD95,或参与溶酶体内化的受体,如CD63。以CD20和cd95为靶点的bsAb比不同的抗CD20抗体变体更能抑制人类异种移植瘤小鼠的肿瘤生长。为了提高抗体药物偶联物,我们设计了一种载药bsAb,它除了结合HER2外,还结合受体CD63。荧光共聚焦显微镜显示,能够诱导其内化,改善了her2阳性异种移植小鼠模型的肿瘤抑制作用。
CD47-SIRPα交互,也称之为“别吃我信号”,通过在巨噬细胞上表达的SIRPα抑制表达CD47的细胞的吞噬作用和该靶点过表达在许多固体和血液肿瘤细胞上。这种相互作用也可能被bsAbs破坏。在与Raji肿瘤细胞异种移植的小鼠中,靶向CD20和CD47的IgG-scFv bsAb延长了小鼠的生存期,靶向CD19和CD47的IgG-like bsAb根除了肿瘤,而抗cd47、抗cd20或抗cd19抗体是无效的。
靶向SIRPα在用Burkitt淋巴瘤异种移植的小鼠中不诱导肿瘤消退,尽管结合anti-CD20抗体美罗华导致协同效应和作用于SIRPα和CD70的bsAb减缓肿瘤的生长。然而,bsAb与抗SIRPα抗体联合抗CD70抗体产生的肿瘤生长减少相同。
随着免疫检查点抑制剂的建立及其在肿瘤治疗中的结合,bsAbs正在探索作为这些现有治疗的补充或改进。四价双亲和重定向(DART)结构的MGD013以两价同时靶向淋巴细胞活化基因3 (lag3)和pd -1;它将在晚期实体瘤患者的临床试验中得到验证。在体外,MGD013较单一治疗或联合治疗引起T细胞因子释放增加,提示T细胞活化增加。
MEDI5752是一种结合PD-1和CTLA-4抑制肿瘤浸润淋巴细胞的抗体。这将在晚期实体肿瘤患者的临床试验中进行测试。
IgG样双抗FS118通过其Fab片段靶向PD-L1,通过其Fc区域靶向lag3,也阻断了两条通路。FS118的小鼠抗体,靶向小鼠Lag-3和PD-L1,通过增加CD8:Tregs比值,剂量依赖性的诱导了其抗肿瘤活性,改变了免疫浸润淋巴细胞的组成。该结构正在晚期癌症患者的临床试验中进行测试(表S1)。
除了抑制细胞膜上的靶标,肿瘤环境本身也可以成为靶点。Crossmab双抗vanucizumab通过作用于血管生成素-2 (ang2)和血管内皮生长因子- a (VEGF-A)来抑制血管生成。bsAb OMP-305B83靶向δ样配体4和VEGF。在该结构中,两种bsAb都是带有Fc的,因为长的半衰期对于效的因子消耗是至关重要的。
Vanucizumab可抑制多种基因的患者来源的异种移植瘤模型小鼠的肿瘤生长和转移。它还增加了肿瘤内免疫细胞的激活,导致内皮细胞上调PD-L1的表达(在多个同源小鼠模型中已经验证)。在该方法中,在vanucizumab中添加抗pd -1抗体治疗可提高存活率,为进一步合理评价该bsAb联合免疫治疗提供了依据(表3)。
bsAb RO6874813是一个2:2的Crossmab,它采用了一种不同的方法。它与肿瘤细胞上激活TNF相关凋亡诱导配体受体之一的死亡受体(DR) 5和肿瘤相关成纤维细胞上的纤维母细胞活化蛋白(FAP)具有亲和力。与之前用抗体激活肿瘤细胞上的DR5的尝试不同,这种bsAb通过对癌症相关成纤维细胞的亲和力增强了对肿瘤的特异性。在体外和人移植成纤维细胞与不同的癌症或病人来源的肉瘤组合的小鼠模型中,这种bsAb的有效性取决于与癌症相关的成纤维细胞的存在。在体内模型中,bsAb比抗dr5治疗更有效地抑制肿瘤生长。
blinatumomab和emicizumab的批准刺激了bsAbs进入临床试验(图4)。在采用小分子量双抗治疗患者时,需要持续给药,如blinatumomab,以保持恒定的血药浓度。解决这一不足的一种方法是通过添加Fc区域延长bsAbs的半衰期。
目前,两种流行的小型bsAb平台BiTE和DART平台,在临床试验中都有Fc区域扩展版本(图1C)。针对DLL3和CD3的AMG757是BITE-Fc;MGD007和MGD009分别靶向糖蛋白A33和CD3、B7-H3和CD3,都是为DART-Fc结构。所有这些bsAbs都针对实体肿瘤。MGD007最近完成了复发或难治性转移性结直肠癌患者的一期临床试验(NCT02248805),目前研究结果尚未发表。然而,MGD007的研究设计说明了更长的半衰期的优势;使用每周和三周的治疗方案,而靶向CD123和CD3的DART分子MGD006通过持续静脉输注给AML患者(NCT02152956)。越来越多进入临床试验的新型bsAbs具有Fc区域(图4)。
此外,blinatumomab通过逐步给药来减轻毒性。这种结构的严重毒性是由一种叫做细胞因子释放综合征的全身细胞因子释放引起的,常见于T细胞参与治疗中。除了逐步给药,皮质类固醇也用于减少细胞因子释放综合征。

图4正在开发中并在ClinicalTrials.gov网站上注册针对癌症患者开展临床试验 的BsAbs。线条显示每年使用的结构数量,bsAbs显示为点。他们在图表中的位置显示了所使用的结构和他们第一次临床试验的开始日期。
最近,通过细胞因子水平检测,在人类B细胞淋巴瘤的小鼠模型中,使用抗CD20抗体预处理后,给予CD20-和cd3靶向Crossmab bsAb可降低毒性。在该研究设计中,预处理使外周血和继发性淋巴器官中的B细胞减少,从而防止了它们的意外激活,避免了招募免疫细胞的bsAb释放细胞因子。
此外,最近对同源小鼠肿瘤模型的研究表明,具有不同CD3亲和力的her2靶向的bsAbs的分布存在差异。CD3的高亲和力降低了全身暴露,并向淋巴组织转移摄取)。另一项研究表明,参与CD3和c型凝集素样分子-1的bsAb的副作用依赖于CD3的亲和力:在食蟹猴实验中高亲和力变异导致细胞因子释放水平增高。
这些发现强调了对像bsAbs这样的新结构进行广泛的药代动力学研究的必要性,例如通过分子成像。双特异性抗体结构的设计是一个挑战,因为该药物的生物分布是由该结构的两个部分以及该结构的所有其他药效学特性决定的。虽然有许多方法来测量新药的药代动力学,但分子成像是唯一的非侵入性方法。
分子成像研究可用于建立双特异性结构部分药代动力学的预测模型,并制定最佳的给药策略。这对于所有尚未在临床试验中评估的不同结构尤其重要。
分子成像用于药物动力学研究的一个例子是一种用于正电子发射断层扫描的锆89标记的AMG211示踪剂。AMG211是一种针对CEA和CD3的BiTE。在对晚期胃肠道腺癌患者的I期试验中,使用这种方法对转移瘤进行了成像。患者体内和患者之间存在异质性肿瘤摄取,淋巴组织中存在cd3特异性摄取。
评估这些药物的临床试验证明,人们对bsAbs作为治疗癌症的一种方法非常感兴趣。bsAb目前用于临床实践,但没有一种正在进行癌症治疗的三期临床试验。大多数被评估的bsAbs具有相同的作用机制:免疫细胞与肿瘤细胞的结合。在递送有效载荷方面,使用bsAbs的热情似乎由于诸如click化学等简单的共轭方法的出现而有所减弱。
临床前研究表明,免疫细胞参与的bsAbs与抗pd1、抗pd – l1等免疫调节剂联合使用后,其抗肿瘤作用增强。最初的临床结果证实了这一点,但还需要更多的数据。将进入临床试验的不同而新颖的bsAbs结构也为使用分子成像揭示其体内行为提供了强有力的论据。近年来,bsAb已成为一种多用途的工具,但除了blinatumomab,它还没有导致临床突破。然而,由于越来越容易生产以及双特异性抗体独特的作用机制,bsAbs可能成为一个有价值的抗肿瘤军火库的补充。
关注公众号,输入bsAbs,可获得原文和我们统计整理的bsAbs的最新临床试验数据。
A review of bispecific antibodies and antibody constructs in oncology and clinical challenges
一直以来新药圈科学家、投资界同业朋友都非常关注和喜欢BiotechVC发布的文章和报告,因为总是有一些鲜明的观点和独具见解的insights,或多或少地帮助到部分新药研发者和投资者更多的思考。
本次沙龙,BiotechVC团队将分享的最新的研究成果、实践认知和思考。
发布者:药时代,转载请首先联系contact@drugtimes.cn获得授权



 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
