

01
严格来讲,PI3K其实不是一个蛋白,它是由一个催化亚基和一个调节亚基组成的复合物,我们通常讲的PI3K抑制剂一般为PI3K催化亚基的抑制剂。
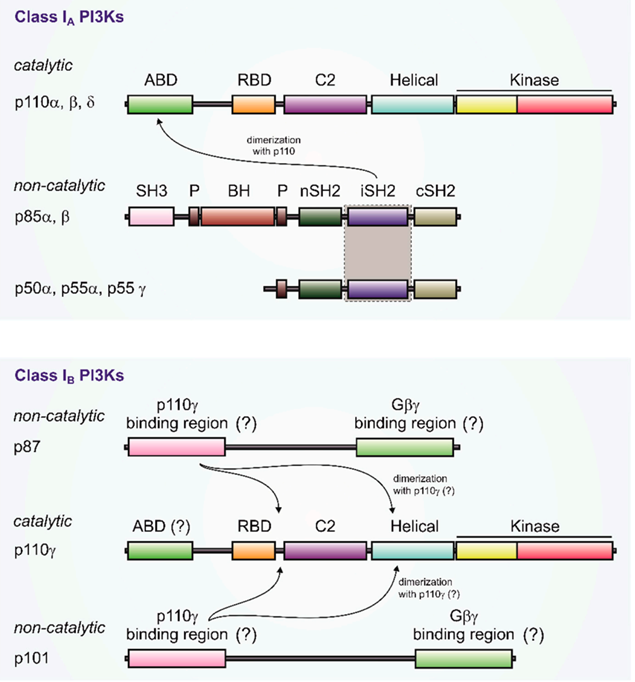
根据结构和底物的特异性不同,PI3K可分为I型、Ⅱ型和Ⅲ型3类。其中,I型PI3K是目前研究最深入、最广泛的亚型,其与肿瘤的关系也最为密切,而I型PI3K又分为IA和IB两型。IA型PI3K的催化亚基包括p110α、p110β、p110δ等三个蛋白,IB型PI3K的催化亚基只有一个——p110γ,根据催化亚基的不同,这些PI3K被依次称为PI3Kα、PI3Kβ、PI3Kδ、PI3Kγ。从表达上来看,PI3Kα、PI3Kβ在多种细胞中表达,而PI3Kδ、PI3Kγ则只在免疫系统中表达。Ⅰ型PI3K的结构如下图所示:
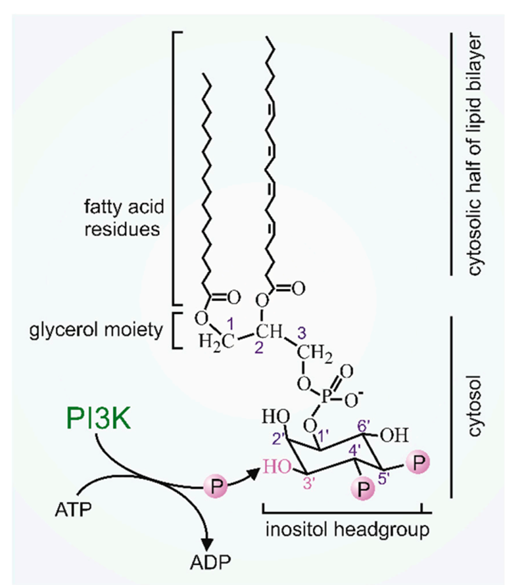
PI3K位于众多重要信号通路的关键性信号位置。当上游信号G蛋白偶联受体(GPCR)或受体络氨酸激酶(RTK)激活时,PI3K的调节亚基p85被募集到质膜附近,催化磷脂酰肌醇-4,5-二磷酸(PIP2)磷酸化形成磷脂酰肌醇-3,4,5-三磷酸(PIP3):
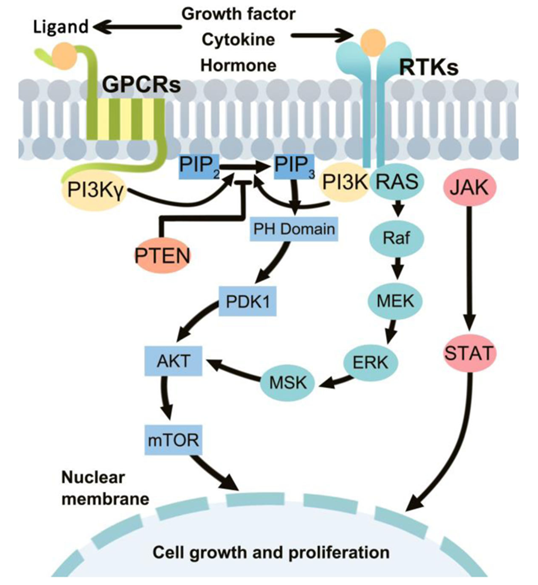
PIP3作为第二信使可激活下游一系列信号通路。PIP3与AKT(又称PKB)的N端PH结构域结合,使AKT转移至细胞膜上;在PDK1的协助下,PI3K通过磷酸化AKT蛋白上特定的位点而激活AKT。活化后的AKT可通过抑制GSK3以cyclin D1从而调节细胞周期;也可通过抑制Bad对抗细胞凋亡;还可增加核转录因子NF-kB的转录活性,从而增加肿瘤细胞的运动能力,促进肿瘤转移。此外,活化的AKT还可以磷酸化激活mTOR信号通路,进而影响细胞生长和细胞周期。PI3K信号通路如下图所示:
02
PI3K的靶向治疗
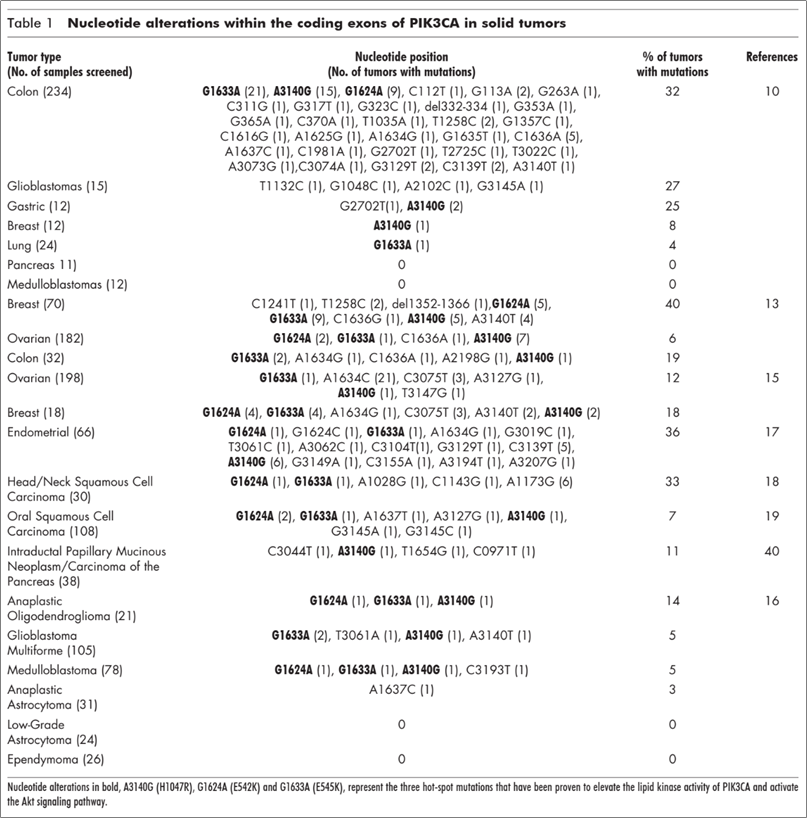
上文已经介绍了PI3K及其下游的信号通路。作为连接细胞膜表面受体和细胞核内转录活性的重要桥梁,PI3K信号通路在许多肿瘤中呈现一种过度激活的状态。PI3K信号通路的过度激活原因很多,如抑癌基因PTEN的失活突变、下游信号蛋白的过表达和突变等;而具体到PI3K本身,最常见的基因改变为PIK3CA基因的激活突变(该基因编码p110α亚基)。PIK3CA突变在一些常见肿瘤中有较高的突变频率(如乳腺癌:40%;子宫内膜瘤36%;结肠癌32%),且突变多发生在H1047、E542、E545等三个位点(如下图所示),而发生在I型PI3K的其余三个催化亚基(β、δ、γ)上的突变则相对较少。
I型PI3K的4个催化亚基结构较为相似,下游信号通路也大体一致。虽然它们在不同组织中的表达情况差别很大,且突变主要集中在p110α亚基上,但由于PI3K下游的信号通路极其复杂,单纯抑制某种PI3K亚型可能会由于肿瘤细胞内的代偿机制而产生耐药,因此开发一款泛PI3K(pan-PI3K)的抑制剂似乎是研发立项最佳的选择,早期的PI3K靶向药研发也确实集中在这个方向。但泛PI3K抑制剂开发的最大挑战就是不良反应太强。作为一种激酶,PI3K在细胞内是冗余存在的。有实验证实,要想达到抑制肿瘤细胞生产的效果,必须能够抑制PI3K至少90%的催化活性,这就势必要加大抑制剂的剂量。然而PI3K信号途径在正常细胞内也是不可或缺的(只是表达较低),大剂量的用药往往造成患者难以忍受毒副作用而中断治疗。
下表统计了早年pan-PI3K抑制剂的研发情况,2012年共有11款pan-PI3K抑制剂处于研发后期,大部分已经推进到了临床1期;而到了2017年,上述11款产品中的10款已经终止研发,只有copanlisib走到最后并于2017年获批治疗复发性滤泡性淋巴瘤。在这些中断研发的pan-PI3K抑制剂中,毒副作用过强是最主要的原因,上述事实说明pan-PI3K抑制剂的研发显然已经走到了死胡同。
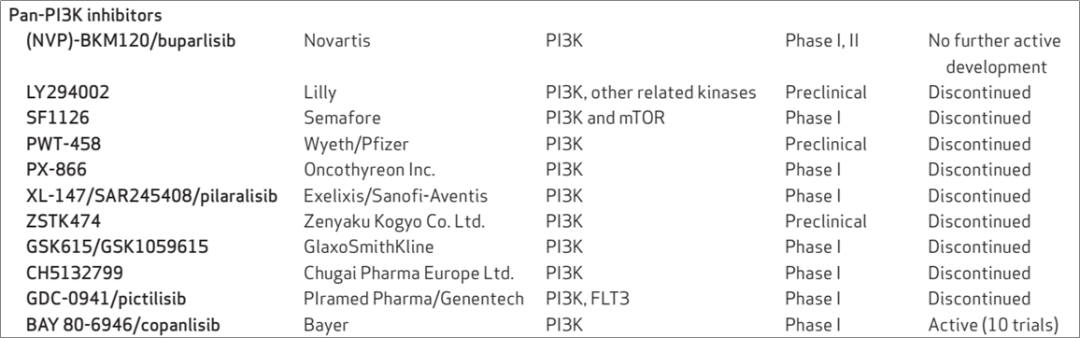
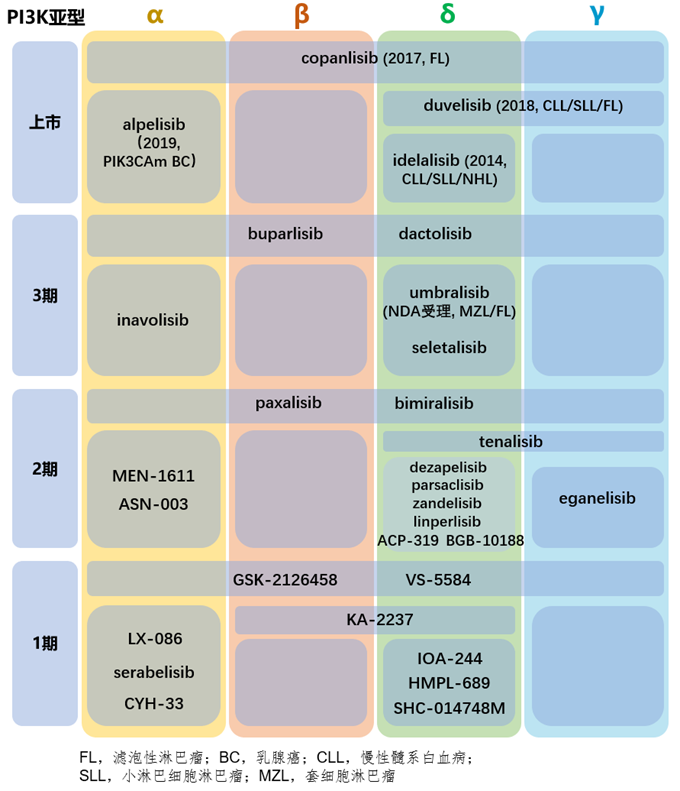
在不良反应的为难之下,研究人员纷纷倒戈,转向研发亚型特异性的PI3K抑制剂。我对目前上市和临床阶段的肿瘤领域的PI3K抑制剂进行了总结(已经终止的项目不再列出,亦未列出PI3K-mTOR等多靶点抑制剂),可以看到在已上市的4种药物中,除了上一段提到的copanlisib外均为亚型选择性的抑制剂。
除了不良反应这一限制性因素以外,早期PI3K抑制剂的药效本身也往往令人失望。我们已经知道,PI3K信号通路在肿瘤中往往发生上调,但这是不是说明抑制PI3K就往往能够取得良好的疗效呢?举了例子:许多体重超标的人很容易出汗,那是不是买点止汗露把出汗的毛病给治好了人就能瘦下来呢?显然并不是这样,因为能量摄入过多才是体重超标的根本原因。
由于PI3K信号通路在肿瘤中的过度激活,早期人们总是想当然的以为PI3K是肿瘤发生的driver oncogene;但无数实验已经证实,与BRAF、BCR-ABL、ALK等经典oncogene的抑制剂相比,PI3K抑制剂在体外对肿瘤细胞的杀伤活性要弱不少。此外,经PI3K抑制剂处理的肿瘤细胞往往只会停止生长而非走向凋亡,这就给了肿瘤细胞通过多种途径产生耐药的可乘之机。再如,在肿瘤细胞中过表达野生型的PI3K,其对肿瘤细胞生长的影响要弱于过表达其它的oncogene。这些事实都说明至少PI3K信号通路对细胞肿瘤本身而言不如原先设想的那般重要,因此后来的药物往往采用联合治疗来增加应答率。在传统道路越走越窄的时候,新机制的发现又给PI3K抑制剂投下了一束曙光。下面就针对不同的PI3K亚型来讨论对应抑制剂的开发进展。
03
PI3Kα抑制剂
PI3Kα在人体各类细胞中均有不同程度的表达,基本没有表现出组织特异性。
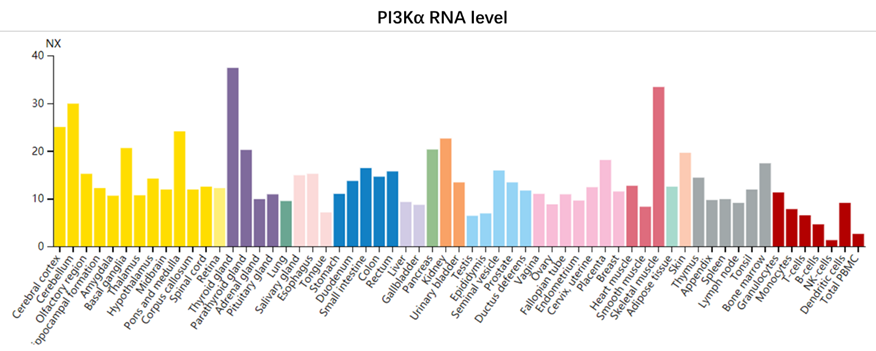
作为乳腺癌、结直肠癌、头颈鳞癌等实体肿瘤中最常见的突变基因之一,PI3Kα抑制剂理应成为研发的热点,但目前为止只在乳腺癌上看到了较为显著的疗效。2019年获批的PI3Kα抑制剂alpelisib的适应症即为HR阳性、HER2阴性的转移性乳腺癌。
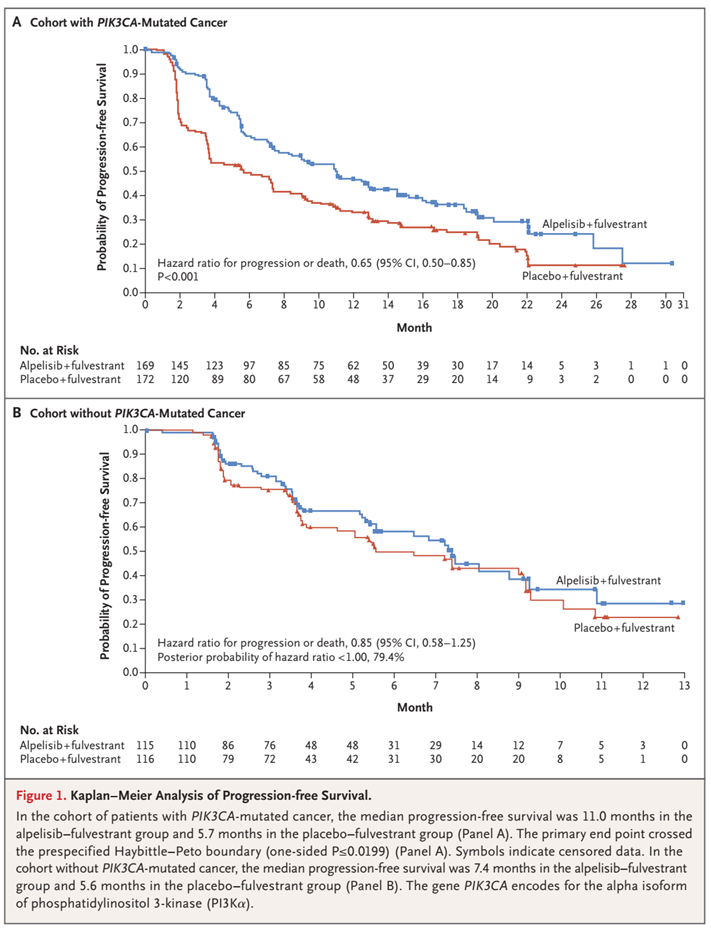
基础研究已经证实,HR+的乳腺癌对PI3K信号通路的依赖程度极高,约40%的ER+/HER2-乳腺癌中可检测到PIK3CA(该基因编码p110α)的激活突变。虽然目前关于PIK3CA突变对乳腺癌预后的影响众说纷纭,但这并不影响PI3Kα抑制剂的开发。SOLAR-1研究结果显示,与氟维司琼单药相比,alpelisib联合氟维司琼可使HR阳性乳腺癌受试者的中位PFS从5.7个月提升至11个月,3-4级不良反应主要为PI3K抑制剂常见的高血糖症(高达36.6%),如下图所示。
由于在除乳腺癌外的实体瘤中收效甚微,PI3Kα抑制剂的研究较少。除了已上市的alpelisib外,还有inavolisib(Roche)、MEN-1611(Menarini)、ASN-003(Asana BioSciences)、LX-086(罗欣药业)、serabelisib(Petra)、CYH-33(海和药物)等六款产品处在临床研究阶段。
04
PI3Kβ抑制剂
PI3Kβ蛋白的表达不存在组织特异性,在人体各类组织细胞中均有不同程度的表达:
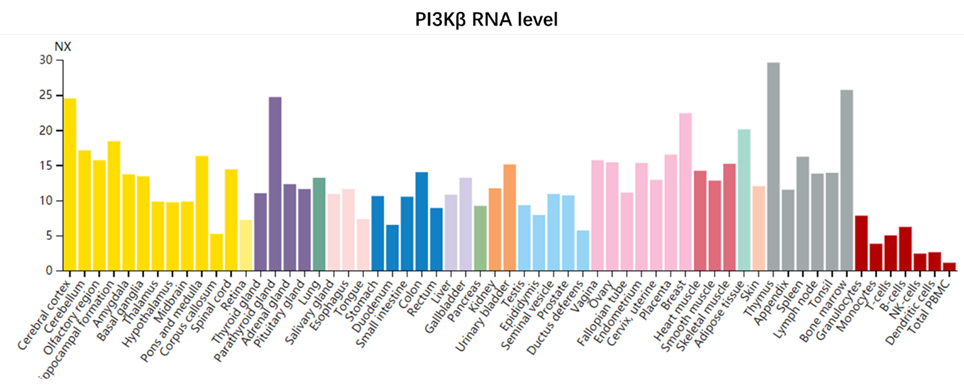
前文已经对PI3K各亚型的靶向药研发现状进行了总结,从中可以看出,研发中的PI3Kβ抑制剂几乎可以用“门可罗雀”来形容,只有几款多靶点抑制剂处在临床研究阶段,因此本小节不再对具体药物展开讨论。
虽然走的人不多,但这也未必就是一条绝路。有研究表明,PTEN突变的肿瘤细胞似乎对PI3Kβ抑制剂异常敏感,尤其是前列腺癌和乳腺癌中。已有多个数据表明PI3Kβ特异性抑制剂能够有效杀死PTEN缺失的肿瘤细胞,但这些数据均来自于细胞水平或动物模型,期待日后能够在临床研究中看到类似的结果。
05
与α、β两种在各细胞中均有表达的亚型相比,PI3Kδ主要在免疫系统中表达。
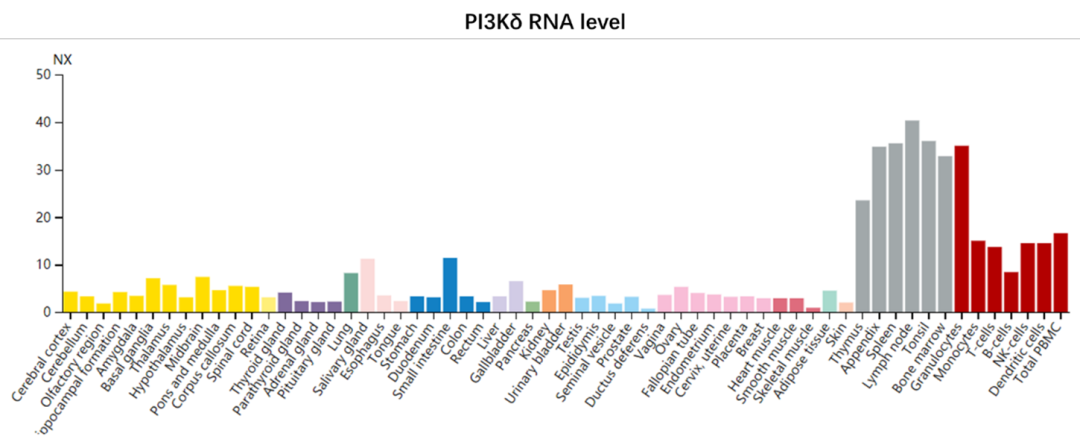
PI3Kδ的活性与B细胞的分化和发育密不可分,例如小鼠PI3Kδ基因的缺失会导致B细胞数量大大下降,因此PI3K抑制剂主要在各种B细胞恶性肿瘤中展开探索。Idelalisib是最早进入临床研究阶段的PI3Kδ抑制剂,令人欣喜的是这款药物在多种B细胞恶性肿瘤上都收获了奇效。但令人意外的是,后续的机制研究表明idelalisib对B细胞的杀伤并不是通过直接诱导细胞凋亡来实现的,而是通过将恶性的B细胞“驱离”淋巴结,从而使B细胞离开赖以生存的肿瘤微环境从而丧失活性。
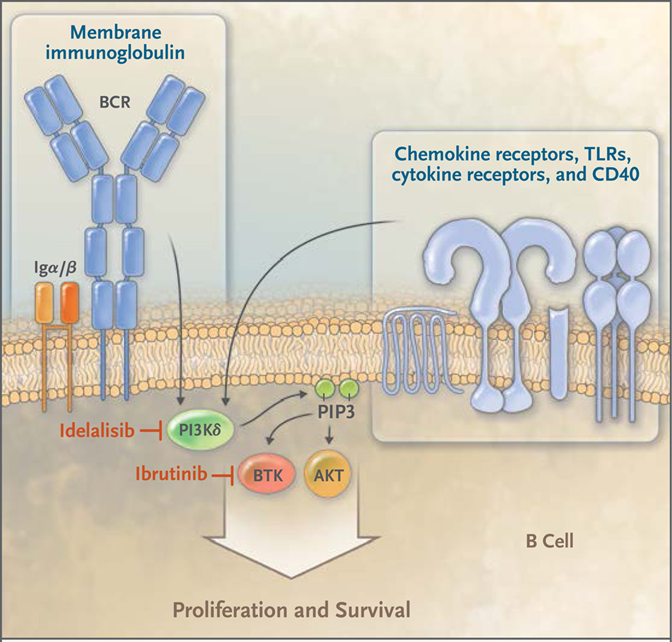
事实上,PI3Kδ与B细胞淋巴瘤领域的另一类特效药——BTK抑制剂同处BCR信号通路的下游,对B细胞的生长和增殖极为重要(如下图所示)。Idelalisib能够抑制B细胞的生长和增殖,还能通过下调多种趋化因子受体的表达来抑制B细胞的再循环。2014年,Idelalisib(商品名:Zydelig)片剂获批上市,用于治疗复发性慢性淋巴细胞白血病(CLL)、复发性滤泡性B细胞非霍奇金淋巴瘤、复发性小淋巴细胞淋巴瘤(SLL)。
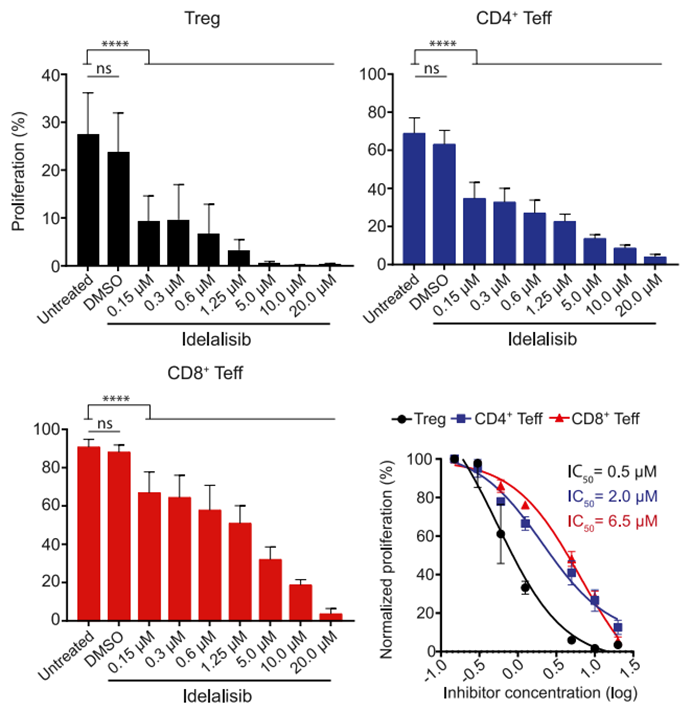
随着研究的深入,研究人员逐渐意识到,除了直接抑制肿瘤细胞外,对肿瘤微环境中Treg的抑制作用也是PI3Kδ抑制剂发挥功能的重要途径。虽然idelalisib对具有抗肿瘤功能的Teff也有不利的影响,但显然其对Treg的抑制作用更大(如下图所示)。这说明即使是已经成功获批上市的靶向药物,其作用机制也未必已经完全探明,基础研究的进步已经成为新药开发的重要推动力。
作为首个收获惊人疗效的PI3K抑制剂,idelalisib有着众多的追随者。目前已经进入临床研究阶段(且并未终止)的PI3Kδ选择性抑制剂超过10种,其中TGTherapeutics的umbralisib已于2020年初提交NDA。duvelisib虽然是双靶点抑制剂,但其对PI3Kδ的抑制效果要远高于对PI3Kγ的抑制效果(duvelisib对PI3Kδ的IC50为2.5nM,对PI3Kγ的IC50为27.4nM),因此其疗效也主要是通过抑制PI3Kδ来实现的。duvelisib已于2018年获批治疗CLL、SLL、FL等B细胞淋巴瘤。
06
PI3Kγ抑制剂
与PI3Kδ类似,PI3Kγ也主要在免疫系统中表达:
与PI3Kδ抑制剂热火朝天的研发现状相比,PI3Kγ抑制剂的研发也略显惨淡,只有infinity的eganelisib进入了临床研究阶段,该药物已于2020年获得了治疗TNBC的快速通道资格。
尽管现状不尽如人意,但我们仍要相信PI3Kγ抑制剂的未来充满光明。2016年,Nature杂志上同期发表了两篇研究论文,对PI3Kγ在肿瘤微环境中的重要功能进行了研究(如下图所示)。这两个研究从不同的角度证明了PI3Kγ对肿瘤微环境中M2型巨噬细胞发挥免疫抑制功能具有重要的意义,而PI3Kγ抑制剂可以通过抑制M2型巨噬细胞,使原本对PD-1、CTLA-4等抗体耐药的肿瘤细胞丧失对免疫治疗的耐药性。上述研究揭示了PI3Kγ在与免疫检查点抑制剂联合治疗实体瘤方面有着广泛的应用空间。

Infinity的eganelisib(IPI-549)是首个也是目前唯一一个进入临床研究的PI3Kγ抑制剂。2020年5月,Infinity公司公布的phase 1/1b MARIO-1研究数据显示,eganelisib联合O药在多个多线治疗后复发实体瘤中收获疗效(这些病人均对先前PD-1免疫治疗耐药)。目前eganelisib已经获得了治疗TNBC的快速通道资格。
PI3Kγ可能是PI3K蛋白4个亚型中最值得投资者关注的靶点。前文提到的PI3Kδ虽然也有抑制肿瘤微环境中Treg的功能,但其在实体瘤中的疗效尚未得到验证。
参考文献
3、Zheng W, Pollard J W. Inhibiting macrophage PI3Kγ to enhance immunotherapy[J]. Cell research, 2016, 26(12): 1267-1268.
4、Kaneda M M, Messer K S, Ralainirina N, et al. PI3Kγ is a molecular switch that controls immune suppression[J]. Nature, 2016, 539(7629): 437-442.
5、Okkenhaug K, Graupera M, Vanhaesebroeck B. Targeting PI3K in cancer: impact on tumor cells, their protective stroma, angiogenesis, and immunotherapy[J]. Cancer discovery, 2016, 6(10): 1090-1105.
6、Chellappa S, Kushekhar K, Munthe L A, et al. The PI3K p110δ isoform inhibitor idelalisib preferentially inhibits human regulatory T cell function[J]. The Journal of Immunology, 2019, 202(5): 1397-1405.
– END –
免责声明
内容仅供感兴趣的个人谨慎参考,非商用,非医用、非投资用。版权归作者。衷心感谢!
本文为转载,药时代持中立态度,请理性阅读
版权声明:文中图片取自网络,根据CC0协议使用,版权归拥有者。
任何问题,请与我们联系。衷心感谢!
PPT分享 | KRAS抑制剂发力!ORR达45%,DCR达96%!Adagrasib单药治疗晚期非小细胞肺癌最新数据公布



 点击收获更多精彩!
点击收获更多精彩!
发布者:药时代,转载请首先联系contact@drugtimes.cn获得授权

 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
