
⬆️欢迎参加2020中国NASH大会!
本文授权转载自药渡,点击访问原文链接
引言
药物开发的新领域
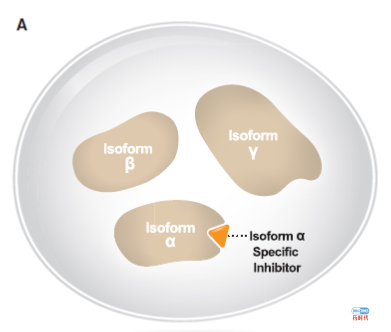
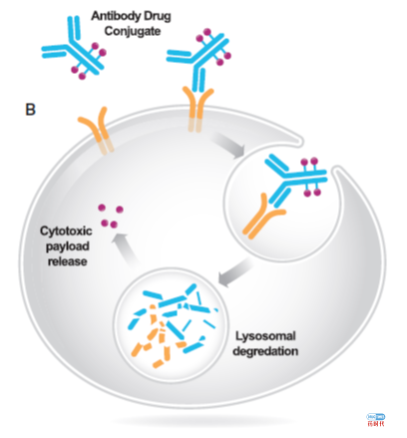
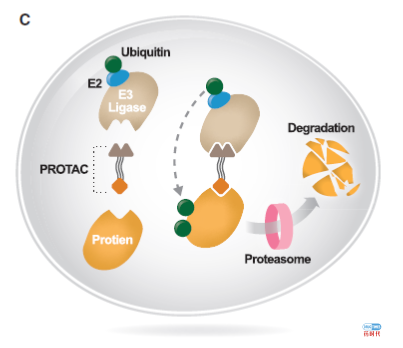
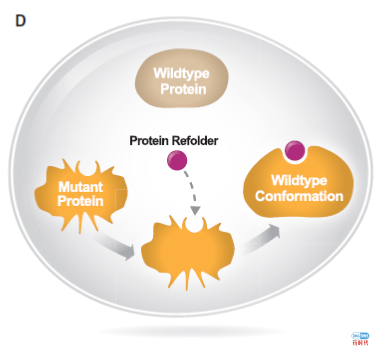
优化药物使用
新一代的临床研究
结论
参考文献
~~ END ~~
免责声明
内容仅供感兴趣的个人谨慎参考,非商用,非医用、非投资用。版权归作者。衷心感谢!
本文为转载,药时代持中立态度,请理性阅读
版权声明:文中图片取自网络,根据CC0协议使用,版权归拥有者。
任何问题,请与我们联系。衷心感谢!
研究进展:PD-1疗法响应低?匹兹堡大学针对LAG-3的新研究伸出援手
联盟喜讯|73家医院180余位专家学者参与!1类新药PDVⅢ期临床试验全国研究者会顺利召开!
瞬息万变的新冠疫苗赛道,Moderna刚公布数据就冒风险生产?
CRISPR先驱Jennifer Doudna发现超小型CRISPR酶—CasΦ(Cas12j),这是否将引领另一场技术革新?

 点击这里,与每月3万多朋友们欢聚!
点击这里,与每月3万多朋友们欢聚!
本文转载自药渡,本文观点不代表药时代DrugTimes立场。



 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
