近年来,我们热衷于利用人体自身的免疫系统来对抗肿瘤,主要路线集中T细胞上,这种免疫细胞被“训练”来识别和攻击癌细胞,比如免疫检查点抑制剂。但是免疫疗法只对大约20%的病人有效,研究人员一直试图理解为什么有些人的反应比其他人好。2020年1月16日,《自然》(Nature)杂志一口气连载了三篇论文试图给我们一些新的线索。这三个研究小组发现,B细胞和第三淋巴结构(Tertiary Lymphoid Structures ,TLS)信号在免疫疗法的应答者中往往比无应答者更明显,与目前用于评估免疫治疗结果的典型T细胞信号相比,该信号更为显著。这些系统研究揭示了提示B细胞和TLS可能在抗肿瘤免疫中发挥关键作用。
TLS是出现在慢性炎症病灶或肿瘤中的类似淋巴结的结构,内部包含了一个T细胞、DC细胞、成纤维细胞、B细胞等(详见图1)。TLSs中产生的CD8+细胞毒性效应T细胞与B细胞协同作用,通过直接杀伤肿瘤细胞,也可以通过巨噬细胞和/或自然杀伤细胞介导的抗体依赖性细胞毒性(ADCC)和局部补体激活,使原位杀伤肿瘤成为可能。
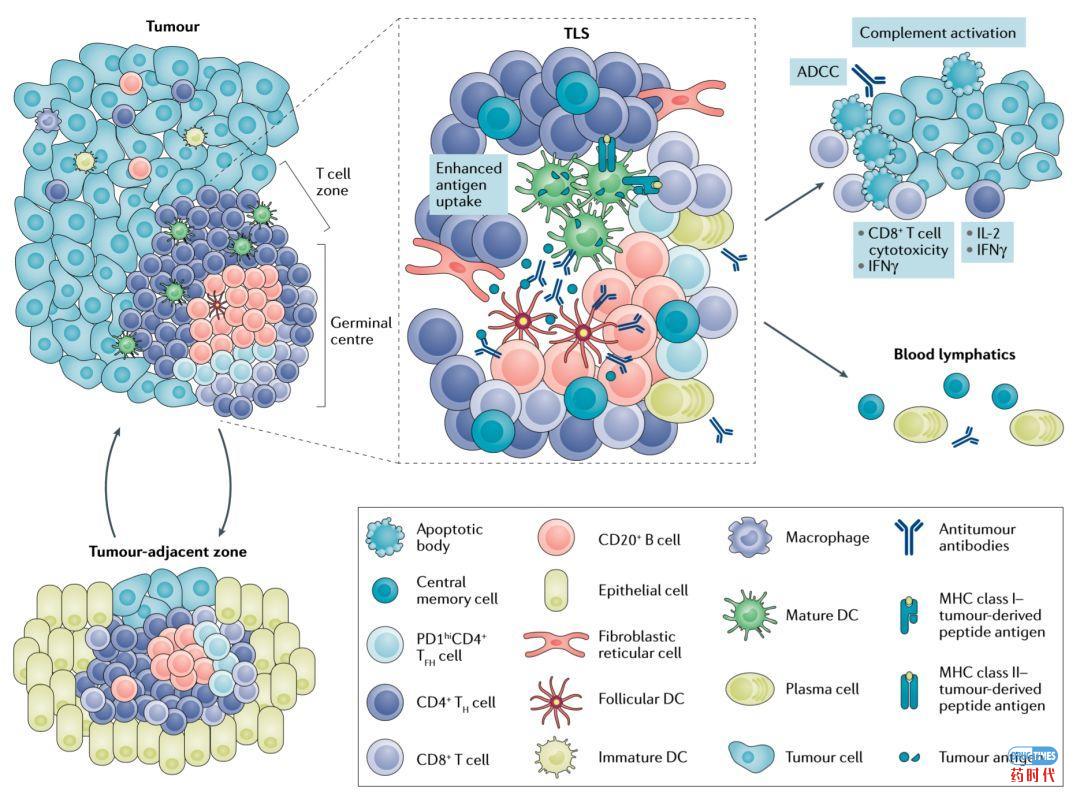
图1:TLS组织结构和功能
资料来源:Nature Reviews Cancer 2019——Tertiary lymphoid structures in the era of cancer immunotherapy
当然,B细胞在抑制或促进免疫系统杀死肿瘤细胞的能力方面有多种作用,这取决于它们是不是位于TLS的未成熟或成熟的结构中(详见图2)。在结构不完善、不成熟的TLS中,有一种假设是B细胞产生抑制因子,这些由B细胞释放出的分子会减弱其他免疫细胞的反应;还有一种说法是B细胞表面的分子会阻碍肿瘤细胞的靶向和破坏,如果B细胞与T细胞的相互作用减少而与恶性肿瘤的相互作用增加,这两种抑制机制都可能出现(见图2a)。本次Nature连载的3项研究间接证明了未成熟的TLS与肿瘤中T细胞的低活性有关。相比之下,结构良好、成熟的TLS中的B细胞不仅可以释放针对肿瘤的抗体,而B细胞还可以向肿瘤中的T细胞提供一种称为抗原(黄色)的肿瘤衍生蛋白,激活T细胞(见图2b)。这些研究表明,成熟的TLS中B细胞的存在与T细胞活性的增加有关,提高了免疫系统靶向肿瘤细胞的能力,并增加了肿瘤对免疫治疗产生反应的可能性。
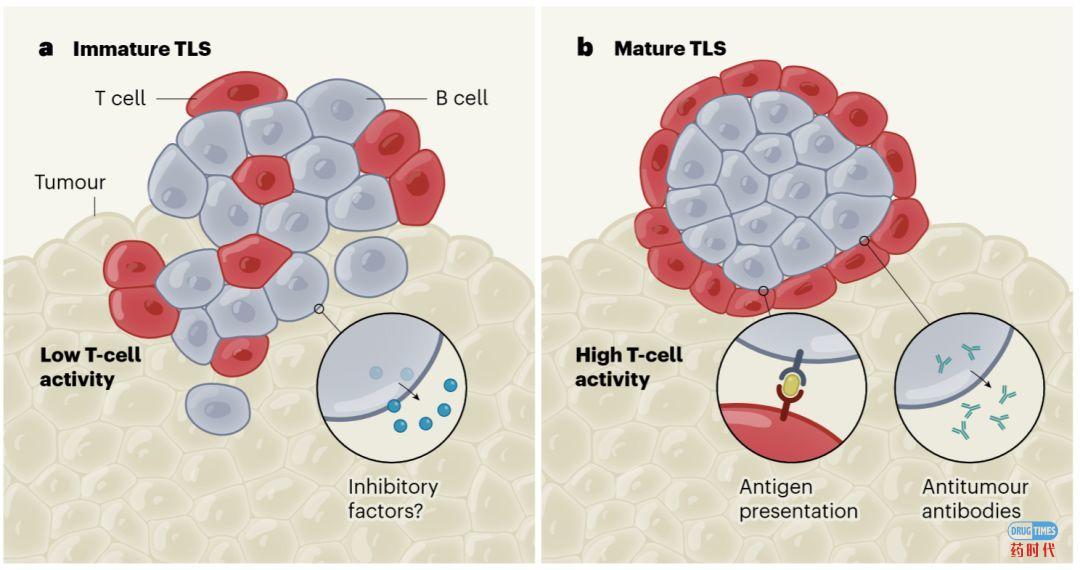
图2:B细胞在肿瘤微环境中多面性
资料来源:Nature 2020—B cells to the forefront of immunotherapy
其实,科学家先前已经发现了肿瘤TLS结构的存在与的肿瘤预后的关系,多个研究表明TLS的存在与肿瘤患者(包括乳腺癌、结直肠癌、胃癌、非小细胞肺癌、黑色素瘤、胰腺癌、肾细胞癌等)的存活呈正相关(详见表2)。
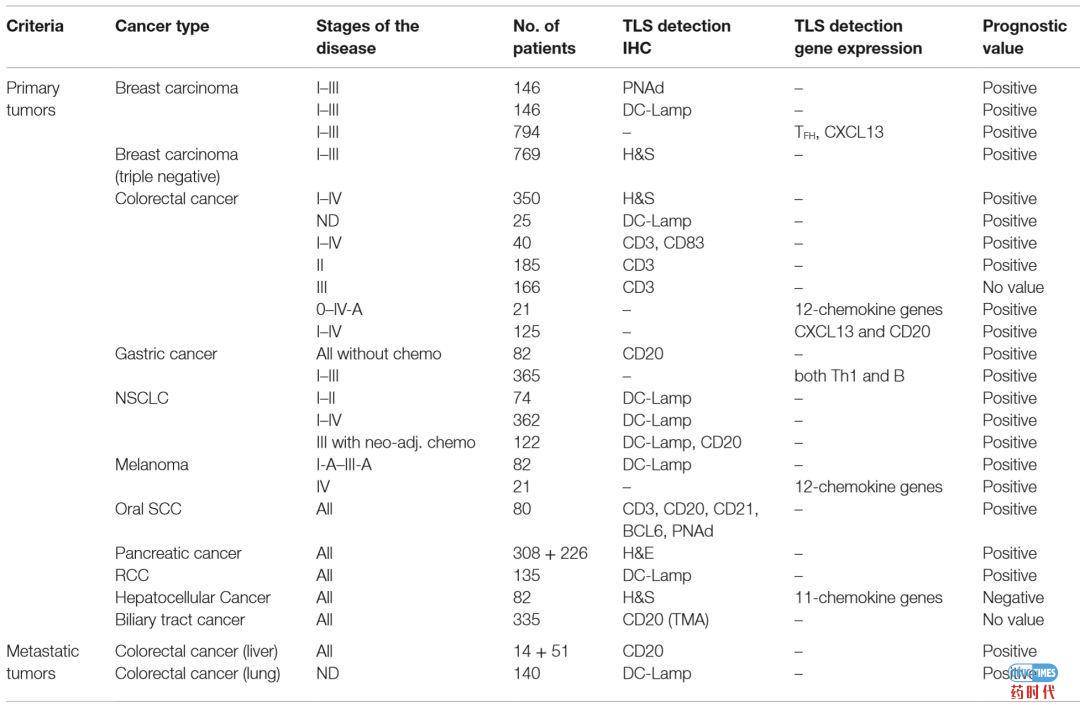
资料来源:Frontiers in Immunology 2016:Tertiary Lymphoid Structures in Cancers: Prognostic value, Regulation, and Manipulation for Therapeutic intervention
以上这些完整的系统研究不仅为免疫治疗的新的预测方法提供了理论基础。医生已经开始尝试将TLS信号作为免疫治疗响应的Biomarker,免疫学家开始研究如何促进更多的成熟TLS形成。有理由相信,新的检测方法和应用会随着对TLS的研究深入变得更加完善和多元。
既然基础研究已经向我们证明了某些肿瘤患者自身潜藏着秘密的B细胞抗体工厂,利用预后良好的肿瘤患者筛选抗体的方案是否可行?
真正的创新者永远在行动的路上
自体抗体完全由人类的免疫系统在完全人类的生物环境中产生的,易于成为表达良好的重组蛋白,安全性良好。这些抗体在体内是通过亲和成熟过程产生的,通常具有良好的亲和性和特异性,这类抗体很难通过短期、非人类免疫或体外策略获得。科学家认为如果能够从长期生存的肿瘤患者中找到抗体,并对其进行体外验证和临床开发,或许能够开发出新颖的抗肿瘤药物。显而易见,通过人体自身发现抗体的策略有两个先天性优点:人源化序列和良好的特异性;当然细想一下,这其中也存在着两个挑战:抗体筛选技术和靶点机理确认。
眼前的困难不能阻挡创新者的步伐,科学家和风险投资已经擦出了火花,国际上已经有Biotech公司利用肿瘤患者人体的抗体开发新型的抗体药物(详见表2)。
表2:通过肿瘤患者发现自体抗体的公司
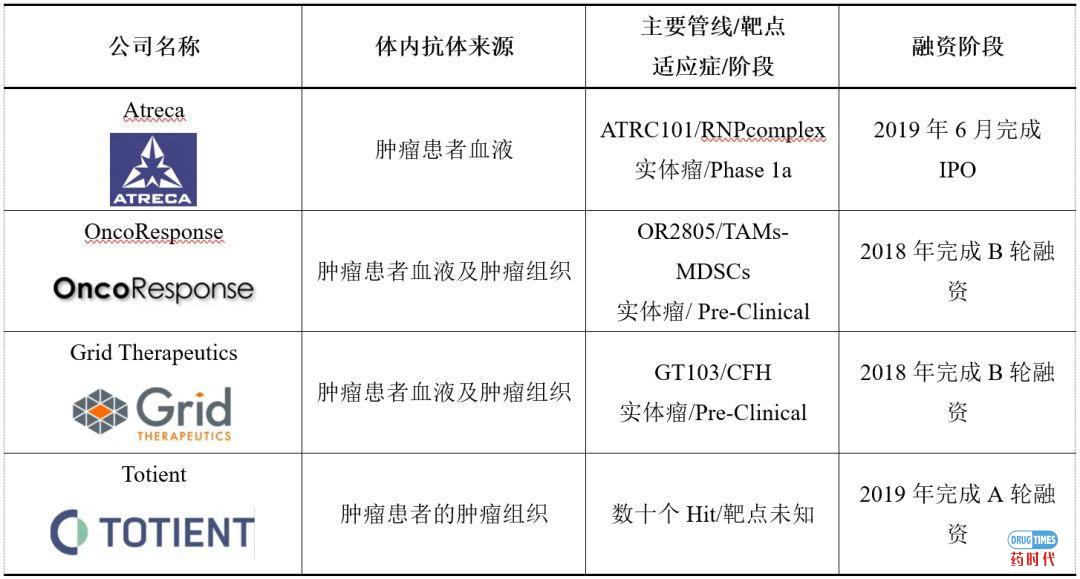
资料来源:根据公开资料整理
Atreca当前进展最快的管线是ATRC-101,已经进入了临床一期试验。ATRC-101是一种单克隆抗体,来源于Atreca特有的抗体发现平台。ATRC-101的作用机制与其他已经或正在临床开发的抗肿瘤抗体不同,ATRC-101为全新的Driver Antigen Engagement机理。
OncoResponse管线中进度较快的抗体为OR-2805,该抗体来源于对检查点抑制剂(CPI)免疫疗法CR(Complete Response)肿瘤患者,靶向的M2-TAMs(Tumor-Associated Macrophages)。虽然公司已经完成了抗体的初步筛选工作,但是整个OR-2805的发现过程类似于表型筛选,具体的靶点确定及机理验证工作并未披露。
Grid Therapeutics从Duke大学引进了CFH(Complement Factor H)抗体GT103,目前处于IND-enabling阶段。Duke大学医学院的Patz教授发现拥有自体CFH抗体的患者,仅有6.7%的患者发生了转移,而没有自体CFH抗体的患者有53.3%发生转移,研究证明肿瘤CFH蛋白可以保护肿瘤组织不被补体C3b结合,帮助肿瘤免疫逃逸。
Totient是一家处于临床前阶段的肿瘤免疫治疗公司,拥有一个独特的从肿瘤组织数据库进行虚拟筛选抗肿瘤抗体药物的平台。通过前期的虚拟筛选,Totient已获得数十个Hit,并正在对这些hit进行体内、体外功能鉴定。
从人体发现抗体首先需要解决样本来源和筛选技术的核心问题,上述公司多与癌症治疗中心和大学研究机构有着广泛的合作,以获取患者样本数据以及各类学术支持。比如Atreca与UCSF、Cleveland Clinic合作,Grid与Duke大学合作、OncoResponse与MD Anderson Cancer Center(MDACC)合作等等。各家公司的抗体发现流程大同小异,基本上分为:患者样品获取à抗体杂交筛选à深度测序表达à评估优化等流程,以OncoResponse为例,该公司从MDACC获得患者的血液、肿瘤组织及病理学相关数据后,利用发现平台致力于通过从对癌症免疫疗法反应异常良好的患者(Elite Responders)的免疫系统中识别跨癌种的新型抗体候选药物,从而提高癌症免疫疗法的成功率(详见图3)。这个平台可以快速筛选数以万计的人体免疫系统制造的抗体,以鉴别具有特殊反应性和相关特性的抗体。
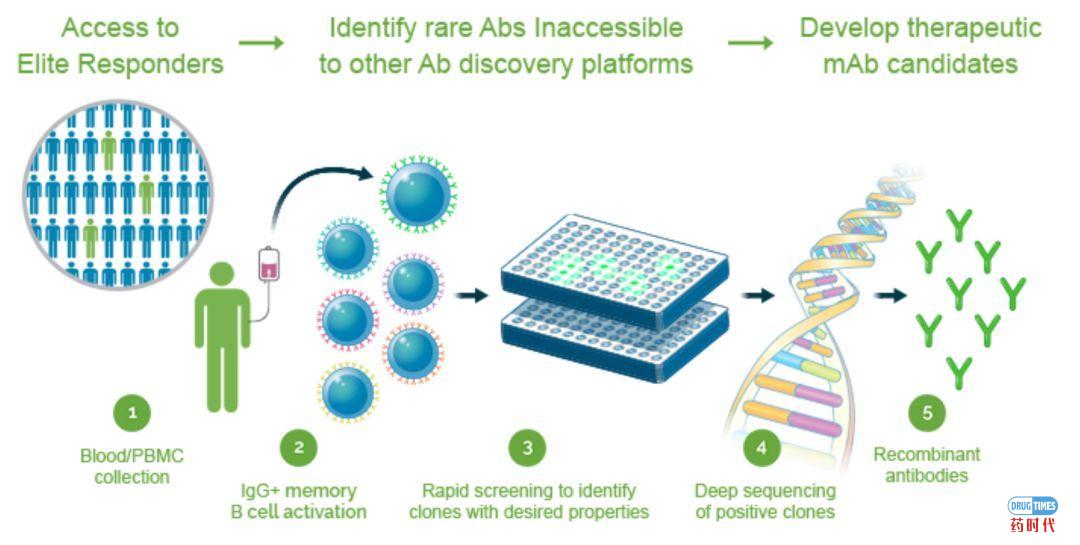
图3 :OncoResponse公司抗体筛选流程
资料来源:OncoResponse公司官方网站
Atreca公司如何寻找新抗体
人类免疫系统存在一个巨大的新靶点空间,基因通过外显子、糖基化和分子复合物的形成、蛋白质折叠、表达和定位等现象产生大量的新靶点。拥有差异化的抗体发现平台和筛选方法对于新抗体的开发尤为重要。Atreca的抗体筛开发流程如下(详见图4):
1. 在癌症患者接受治疗之前、期间和之后收集血样,识别对免疫治疗反应良好的患者(CR、PR、SD≥6个月或者长期PFS)。在免疫反应活跃的阳性患者的样本中筛选罕见的产生抗体的B细胞,即浆母细胞。
2. 分离单个B细胞,利用专有的IRC技术并对共表达的重链和轻链抗体基因进行测序,构建每份样本的免疫组库。对比患者治疗前与治疗后的免疫组差别,能选定1%的抗体序列进行进一步分析;
3. 经过对序列的分析,对选出来的抗体序列进行表达,并在人体肿瘤上(与抗体序列来源不同的供体的肿瘤,以保证抗原是相对普遍存在的)进行结合测试;
4. 通过一系列的体内外实验,包括多种动物模型,通过增加、移除或改变蛋白质序列优化Hit抗体,以期得到先导化合物;
5. Lead结构的优化与作用机理分析,确定药物最后的结构、起效方式以及拓展适应症。
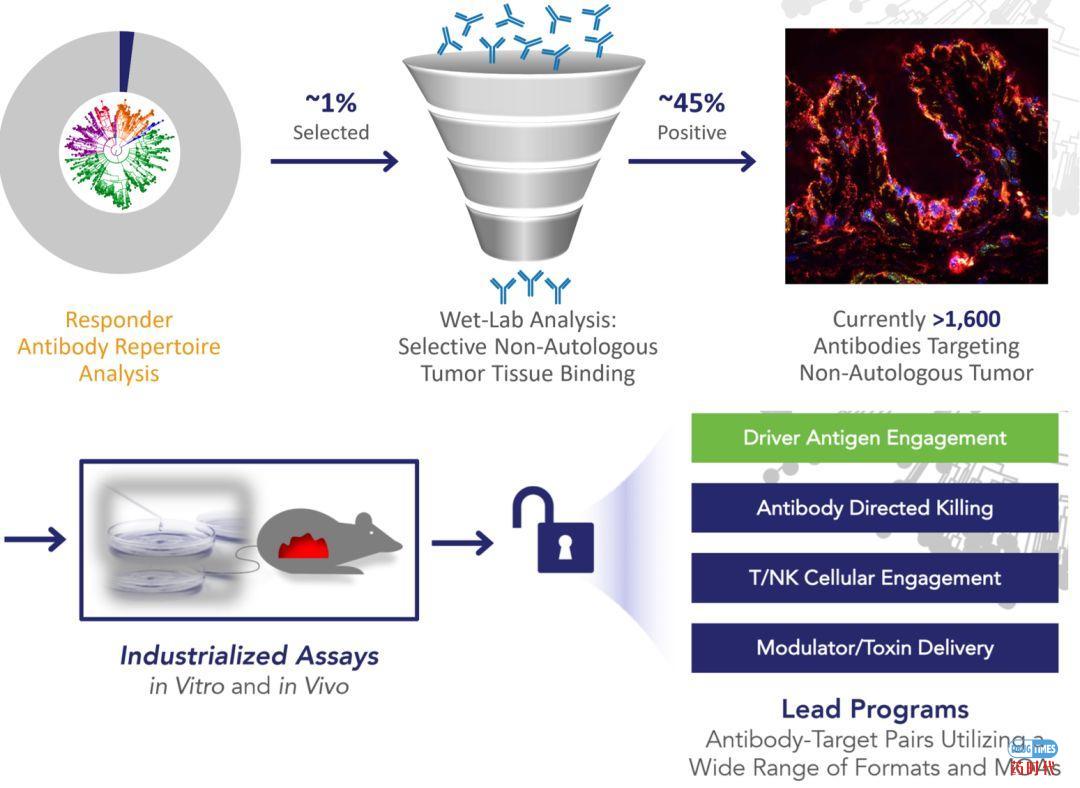
图4:Atreca抗体筛选流程
资料来源:Atreca官方网站资料
“技术平台”这个词汇是投资人经常听到的高频词汇,似乎每个公司都有自己所谓的“平台”,其实技术平台的搭建除了将经验标准化的技术之外,还必须要有独特的优势,否则只会沦为无差别的“标准操作”。至于平台的优势如何鉴定,我们认为还是要聚焦到具体管线的质量和开发速度。Atreca利用自研的IRC(Immune Repertoire Capture)技术搭建的抗体筛选平台已经筛选出了超过1200个针对25种不同的实体肿瘤的抗体库。那么Atreca的管线质量如何?接下来我们以其主要管线ATRC-101为例继续分析。
ATRC-101:全新靶点+全新机理
ATRC-101单抗来源于Atreca的IRC发现平台,目前已经进入临床一期试验。ATRC-101不仅在多个肿瘤模型中作为单一药物显示了强大的抗肿瘤活性,还与包括PD-1检查点抑制剂在内的其他免疫疗法联合显示了临床前活性。ATRC-101的潜在适应症包括卵巢癌、非小细胞肺癌、结直肠癌和乳腺癌等等。
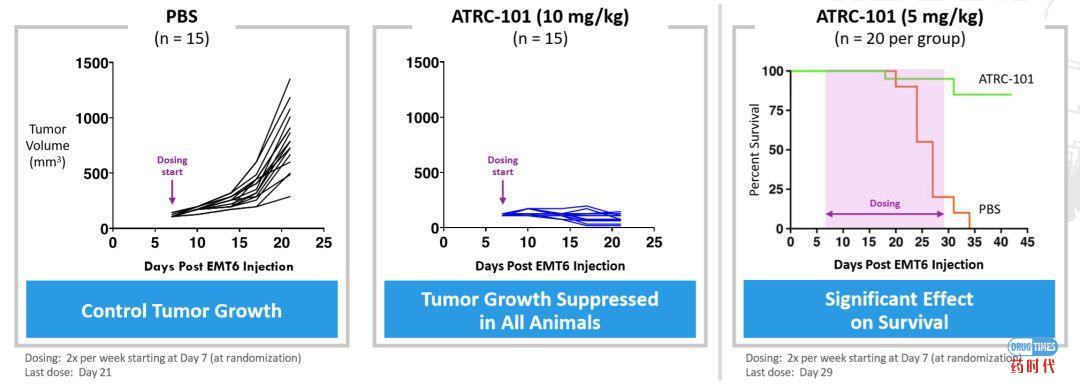
图5:ATRC-101动物药效
资料来源:Atreca官方网站资料
ATRC-101的靶点验证必定是一个复杂的过程,虽然公开资料没有透漏具体的细节,仅仅描述利用免疫沉淀和质谱实验初步鉴定靶点为RNP(Ribonucleoprotein)复合物,即PABP-1和mRNA组成的核糖蛋白复合物(详见图5左)。根据文献报道,RNP靶点在人体组织中也会表达,是一类较为常见的靶点,在调控细胞周期和代谢起着重要作用。ATRC-101如何解决on-target的副作用问题呢?
Atreca也担心这个问题,于是用免疫组化的方法评估了ATRC-101在一系列正常人体组织中的结合反应,结果在30个不同的正常人体组织(包括大脑、小脑、心、肺、肝、肾、胰腺、胃、脾和唾液腺)中没有观察到反应信号。这说明虽然目标靶点的组分尽管该靶点在正常组织中广泛存在,但在肿瘤组织中ATRC-101会选择性地与靶细胞结合,神不神奇?
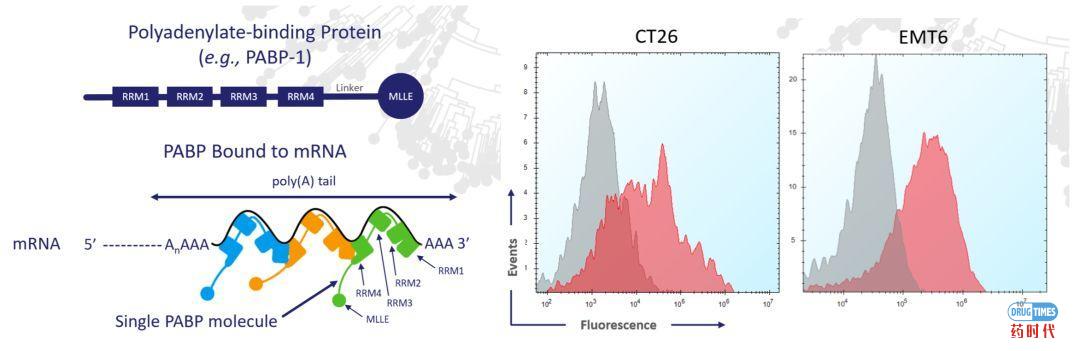
图6:RNP靶点及分布
资料来源:Atreca官方网站资料
FDA不会相信神奇的鬼话,如果这个问题没有一个很好解释的话,申报IND会面临不小的挑战。Atreca后续又做了大量的研究,终于揭开了靶点特异性的神秘面纱:RNP复合靶点虽然在正常组织中和肿瘤组织中都有表达,但是在正常组织中,RNP复合物往往存在于细胞内部,很难游离到细胞膜外;但是由于肿瘤细胞的细胞膜相对脆弱,靶点会游离到细胞表面甚至细胞外(见图5右:RNP target is present extracellularly demonstrated by flow cytometry)。以上的研究很好的解释了为什么ATRC-101会选择性地与肿瘤靶细胞结合。
那么ATRC-101抗体与RNP靶点到底如何作用?抑制肿瘤的机理到底是怎样的呢?在这里Atreca又脑洞大开,论证了一个全新的作用机理——Driver Antigen Engagement。
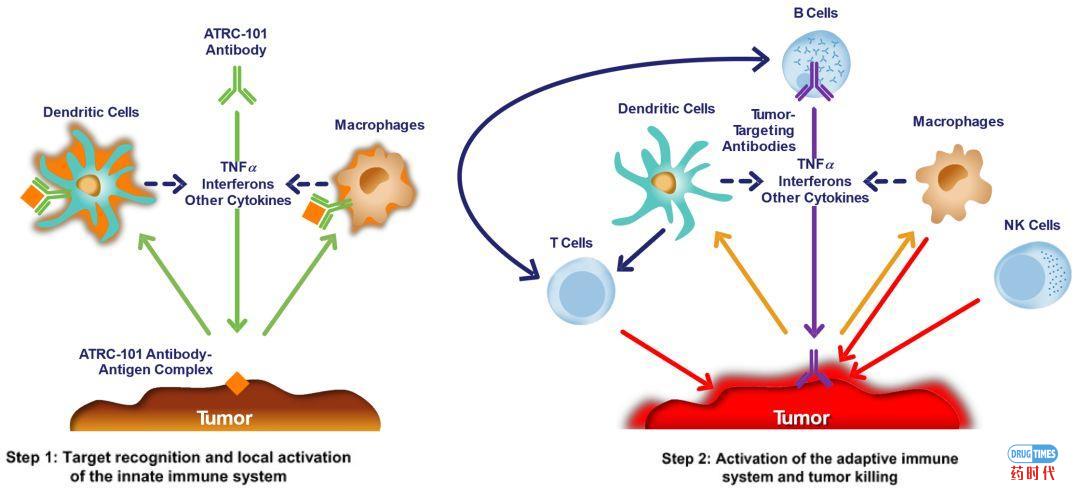
图7:Driver Antigen Engagement作用机理
资料来源:Atreca招股说明书
ATRC-101首先发现并结合其肿瘤特异性靶细胞,通过其FcRs将抗体抗原复合物传递给肿瘤固有免疫细胞(如树突细胞、巨噬细胞等),然后激活这些细胞。被激活的天然免疫细胞分泌细胞因子和其他炎症信号分子,共同导致肿瘤微环境的变化,激活的天然免疫细胞和修饰后的肿瘤微环境将促进细胞毒性CD8+ T细胞的适应性免疫反应,这些免疫反应,攻击并破坏肿瘤细胞。也就是说,ATRC-101利用RNP抗原先后驱动了先天性和适应性免疫系统。当然在论证这个机制的过程中,Atreca也展示了大量的Control试验,限于篇幅限制不再逐一展开。
关于Atreca的筛选平台和主要管线就简单介绍这么多,未来Atreca不仅可以在ATRC-101的基础上发展双抗、ADC等多种分子形式,也会继续深挖自身筛选出的阳性患者抗体库,发掘有临床价值和市场价值的新靶点。
结语
视角转回国内,可能由于公开信息的不足,我们暂时没有关注到国内专注在自体抗体的发现的企业。在我的印象中,国内做的较多的是筹建各种抗体库:全人源抗体库、人源化抗体库及纳米抗体库等等,对外宣传也是重点突出数量,但是这种方式最大的问题还是无法解决靶点束缚的问题,仍要依赖新靶点的发现和验证。
从Atreca公司 10年的创业历程来看,自体抗体的发现之路也充满的挑战。新的靶点、新的机理验证都需要大量的基础研究工作;如何平衡个性化和商业化的矛盾也存在不小的挑战,需要完成大量的抗体筛选和数据分析工作。
但是,我们相信随着测序手段以及生物信息技术的发展,自体抗体的发现速度会不断加速,国内也会涌现出聚焦这一领域的创新公司。
推荐阅读

隙穴之窥-难以成药靶标修炼记
如何对高发病率的抑郁症say no/bye
给China market only 新药算笔账


发布者:药时代,转载请首先联系contact@drugtimes.cn获得授权

 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
