阿片类药物一直是治疗中度至重度疼痛的最有效药物,且被WHO认定为三阶梯癌痛治疗的常规用药,在缓解疼痛上具有无可取代的地位。然而,阿片类药物同时也存在严峻的成瘾、滥用风险,由其所导致的社会问题亦在全球范围内不断凸显。阿片类药物可以通过口服、吸食、静注等多种途径被滥用,其中口服途径滥用占比72%~97%,为阿片类药物最常见的滥用形式。
据WHO统计,每年大约有70000 ~100000人因过量使用阿片类药物死亡。因此,阿片类药物滥用风险的不断催生了能防止篡改和滥用的新型药物制剂的开发,如何能够防止阿片类药物滥用的同时并能满足疼痛治疗的需求,开发能够抵抗各种篡改和滥用特性的新型药物制剂成为世界各国均密切关注的重大公共卫生问题。
为鼓励、支持和加速研发遏制药物滥用的阿片类制剂,2013 年1 月,FDA 率先公布了“防滥用的阿片类药物——评价和说明书”指导原则(草案)。根据该草案,被FDA认定为具有遏制滥用特性的产品将被允许在标签上添加“具有遏制滥用特性”的声明,声明共分为4 个等级。该草案的真实目的一方面在于满足患者必需的镇痛治疗的同时尽可能减少和防止阿片类药物的滥用和误用;另一方面也对获得该声明的药品的企业采取保护措施,因为它提出了:仿制药若要上市,除了证明其具有相同的药效、安全性之外,还必须证明具有相同的可遏制滥用特性。所以,该指导原则(草案)的提出有助于促进生产企业投入研发此类产品。
2015 年4 月1 日,FDA 在《联邦记事》中公开发布了“防滥用的阿片类药物评价和说明书”的最终指南。随后,2016 年3 月24 日FDA 再次发布“评价口服固体阿片类药物仿制药滥用威慑的一般性原则”,要求确认仿制药与原研药具有相同的活性成分、剂型、给药途径、规格,以及仿制药与原研药是生物等效的,其非活性成分和组分在按处方使用的条件下是安全的。确保在所有可能的滥用途径下,仿制药具有不低于原研药的防滥用措施,将仿制药滥用的风险降到最低。
目前,阿片类药物产品可以通过多种方式滥用,例如可以整个吞服、压碎后吞服、压碎后鼻吸入、压碎后抽吸或压碎溶解后注射。而防滥用技术开发应针对已知或预期的申报产品相关滥用的途径(见图1)。如今,制药企业开发的具有遏制滥用特性的阿片类药物主要分为三大类(见图2)。需要说明的是:下述分类不是绝对或独立的。
(1). 物理/化学屏障:物理屏障可以防止咀嚼、压碎、切割、磨碎或碾碎;化学屏障(例如胶凝剂)可以防止用一般溶剂如水、模拟生物介质、乙醇或其它有机溶剂提取阿片类药物。物理和化学屏障可以限制机械破坏后药物释放或改变药物物理形式,从而使其不太适于被滥用。
(2). 激动药/拮抗药复方:可以加入阿片受体拮抗药干扰、降低或消除滥用产生的欣快感。拮抗药可被阻隔并且仅在产品破坏后才被释放。例如,可以做成这样一种制剂,其中所含拮抗药在产品被吞服时没有临床活性但是在产品被压碎后注射或鼻吸入时开始起作用;
(3). 厌恶剂:可以向产品中加入一些物质,这些物质在剂型被破坏或在高于所示剂量使用时产生令人不愉快的作用。例如,防滥用制剂可含有在其被压碎后鼻吸入时产生刺激鼻粘膜作用的物质,或者是加入过量服用时可引起人体皮肤潮红、瘙痒等激惹反应的物质,以降低对滥用者的吸引力。
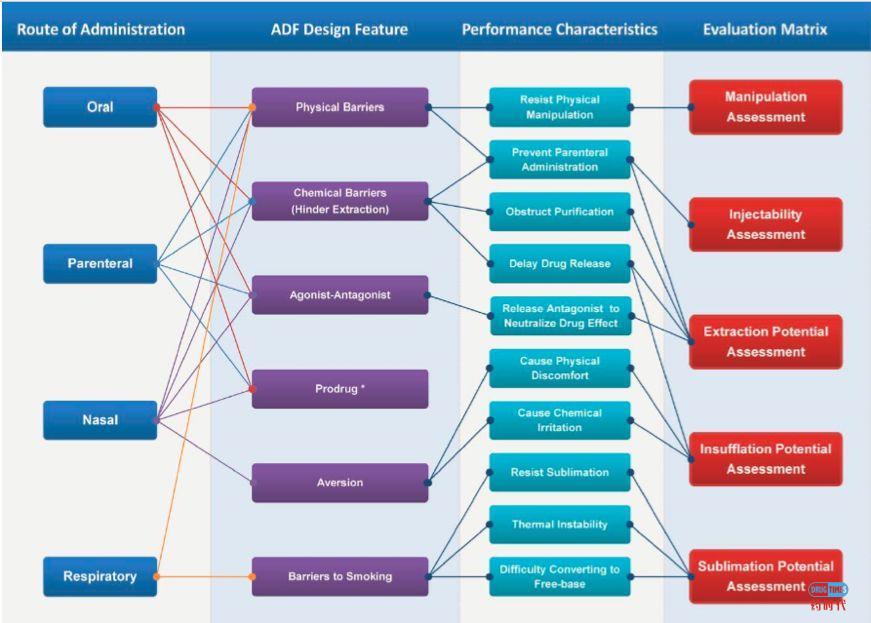
图1:给药途径,防滥用处方设计与药物特点关联图
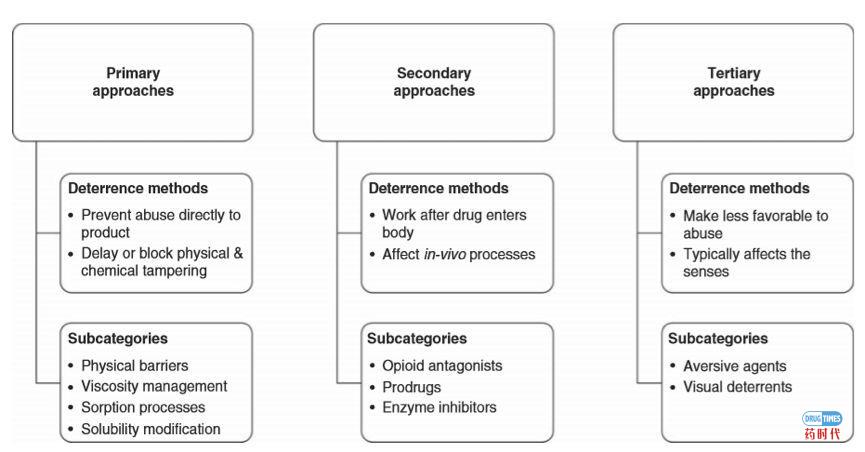
图2. 防滥用处方(ADF)方法分类
截至2018年底,FDA已经批准了10种具有防滥用特性的阿片类药物(见图3),对照上述所提到的防滥用制剂开发的技术手段,我们来逐一分析下:
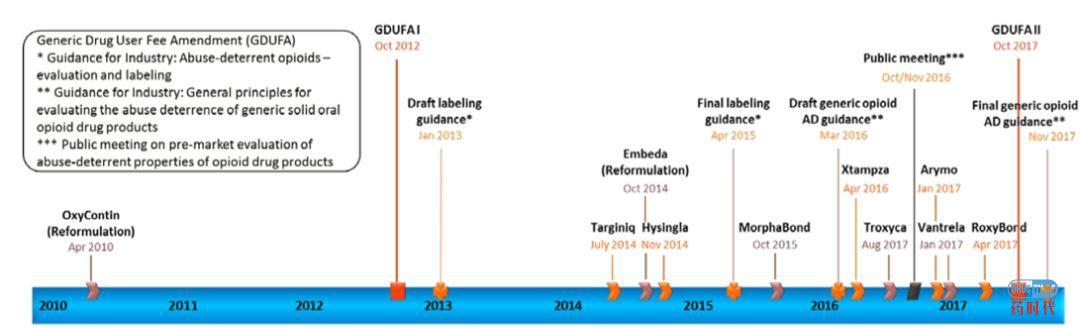
图3:FDA批准上市的“具有遏制滥用特性”标签口服阿片制剂
中文名奥施康定,是盐酸羟考酮的缓释片,主要用于持续的中、重度疼痛患者。
1989年,盐酸羟考酮普通剂型开始在市场上销售,该药物剂型半衰期在3-4h,因此一天需要服用6次左右,或者提高剂量,这对于需要24小时持续止痛的中、重度患者来说,依从性很低。
1995年,普渡制药(PURDUE PHARMA LP)推出第一代羟考酮缓释剂型–奥施康定(Oxycondin,简称OC),半衰期在12小时左右,每天服用2次即可,大大增加了持续疼痛患者用药的依存性。该长效制剂采用双相释放技术(ACROCONTIN™技术),具有达峰迅速、疗效持续的优势,受到市场认可,高峰销售额在20亿美金左右。但该缓释剂型容易被人为破坏后被滥用和误用,成瘾与过量用药等现象严重,引起社会的高度关注。
2010年,普渡制药对第一代奥施康定的制剂进行了改良,使其具有了遏制滥用的特性,推出了第二代羟考酮缓释片(Oxycondin Reformulation,简称OCR或OP),同期原制剂撤市。防滥用奥施康定缓释片受到了FDA的欢迎,销售额一直维持在25亿美金左右。该制剂是在生产过程中经历了一个固化过程,提升压片温度到以软化聚合物辅料;随后冷却,聚合物固化并赋予片剂非常高的硬度,从而能够防止片剂被轻易压碎。此外,处方中还添加了聚环氧乙烷(PEO)和羟丙基甲基纤维素(HPMC),这两种辅料使得片剂溶于溶剂中时,会成为胶状,防止药物成分被溶剂提取用于静脉注射。
一项在2009.06-2012.03来自美国357 个中心的140496个接受吸毒治疗评估案例研究表明:新制剂的滥用比原制剂降低了41%,其中口服途径滥用降低了17%,其他途径滥用降低了66% 。另外一项在2008-2012年来自美国滥用、转移和成瘾相关监视系统(RADARS)的数据分析结果显示,奥施康定新制剂的人均滥用降低了38% 。正是基于奥施康定新制剂的临床数据以及上市后研究,FDA 于2013 年4 月份批准了该产品在标签上添加“具有遏制滥用特性”的声明(第三等级),该产品也是美国历史上第1 个获得该声明的产品。
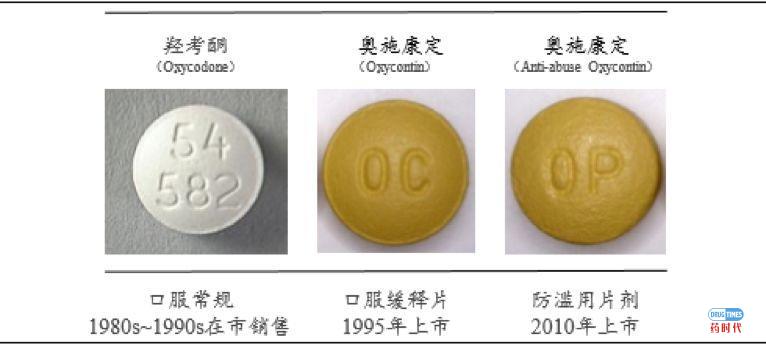
图4:三种盐酸羟考酮
中文名盐酸羟考酮/盐酸纳洛酮缓释片,同样来自普渡制药,FDA于2014年7月23日批准,它是一款缓释兼长效的阿片类镇痛药,用于治疗需每天、不间断、长期阿片类镇痛剂治疗且替代治疗无效、不可耐受或者不足以提供充足疼痛管理的严重疼痛患者。
Targiniq ER是复方制剂,通过内含的阿片受体拮抗剂纳络酮而实现防滥用技术。纳络酮的药代动力学特点是口服吸收差,肝脏的首过效应明显,口服吸收后很快在肝脏中与葡萄糖醛酸结合代谢而失效。所以,非注射给药后其生物利用度非常低(仅为0.9%~2.0%)。因此,在临床使用中纳络酮大多会制备成注射剂适用。但当纳络酮与生物利用度较高的阿片受体激动剂联用时,通过口服途径给药时,因纳络酮生物利用度极低,进入体循环的药量很少,但并不会影响激动剂的中枢镇痛作用。此外,一部分拮抗剂会作用于外周的阿片受体,拮抗激动剂所产生的外周作用,从而减少便秘等不良反应的发生。当通过非口服途径给药时,纳络酮能迅速起效,阻断阿片激动剂的中枢作用,防止欣快感的产生,与单独的羟考酮相比,本品对滥用者的吸引力大大降低。因此,Targiniq TM ER可有效遏制通过静注、吸食等非口服途径的滥用。但是需要特别指出的是,Targiniq ER仍有可能被通过简单吞服方式而滥用,这种方式也是止痛药滥用的最惯常方式,因此未被批准用于按需缓解的疼痛。考虑到Targiniq ER的滥用、误用及成瘾风险,它被批准只用于替代治疗选择无效、不能耐受或否则不足以提供充分疼痛管理的患者。Targiniq ER 是FDA 批准的第2 个在标签中加入“具有遏制滥用特性”声明的阿片类镇痛药。
3、Embeda
中文名硫酸吗啡/盐酸纳曲酮缓释胶囊,来自Pfizer(原King 制药公司),于2009年8 月被FDA 批准上市。Embeda是一种长效的阿片类止痛药,用以缓解需要日夜不断持续以阿片类止痛药治疗较长期的中度至重度疼痛,这是FDA批准的首个长效阿片类药物。
Embeda是复方制剂,每个缓释吗啡胶囊颗粒内均包裹一个盐酸纳曲酮内核(硫酸吗啡∶纳曲酮含量比例为100∶4),该药物是通过内含的阿片类拮抗剂纳曲酮来实现防滥用(见图5)。相比纳络酮,纳曲酮的生物利用度明显提高。在正常吞咽口服的情况下,吗啡在胃肠道内缓慢释放,其药动学参数、药效以及安全性与硫酸吗啡单组分缓释胶囊KADIAN(Actavis)相近,而纳曲酮则几乎不会暴露于人体,因此不影响吗啡的镇痛作用。但如果将本品通过咀嚼、压碎等方式破坏或溶解于酒精中,纳曲酮会被释放,其生物利用度与等剂量纳曲酮速释制剂相当,能迅速阻断吗啡产生的欣快效果,大大降低了该药通过口服、吸食及静注等方式被滥用的可能性。而吗啡的生物利用度与药物是否碾碎没有明显关系[11];同时另一项研究也显示,Embeda中吗啡与一般的缓释吗啡制剂也能达到生物等效,在正常使用下盐酸纳曲酮的加入,并没有影响吗啡的镇痛作用。2014 年10月,FDA 宣布Embeda获得“具有遏制滥用特性”标签,成为第3 个获得此标签的药物。
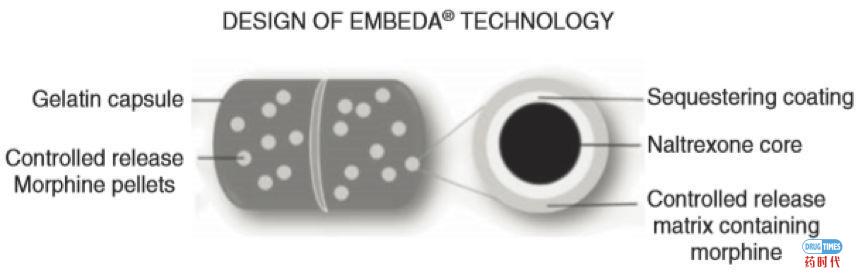
图5. Embeda结构图
中文名是重酒石酸二氢可待因酮缓释片,来自普渡制药,于2014年11 月获美国FDA 批准上市,每日一次,用于长期需要每天无间歇阿片类药物镇痛的中度至重度疼痛的治疗,但仅可用于其他镇痛方法(非阿片镇痛药,速释阿片镇痛药等)均无效、不可耐受或不足以提供足够镇痛作用的情况下使用。
Hysingla ER是第二个被FDA批准的纯粹由二氢可待因酮组成的缓释药物,采用了Purdue Pharma 的专有技术RESISTEC TM ,与奥施康定新制剂类似,可有效遏制通过咀嚼、吸食、注射等途径的滥用。RESISTEC™是普渡制药公司的专利缓释固体口服剂型平台,利用独特的高分子聚合物组合物和制备工艺,使片剂有很高的硬度,而且溶解后会形成一种稠厚的水凝胶,不易被静脉注射使用。这是一项防止药物滥用的制剂技术,主要目的是防止药物通过粉碎、分解或溶解等常见手段从固体制剂中被提取出来,而被滥用或被不法分子利用。
本品是FDA 批准的第4个可在标签中添加“具有遏制滥用特性”声明的阿片类镇痛药(第一和第三等级)。
中文名是硫酸吗啡缓释片,来自Inspirion Delivery Technologies,于2015年10月2日获美国FDA批准,用于需要长期每日24小时以阿片类药物治疗的严重疼痛患者。
MorphaBond采用Inspirion 释药技术公司的SentryBond专利技术(见图6),由非活性成分构成,这使得该药片在保持缓释同时,难以被各类方式滥用,即使是经过物理处理和/或化学提取。相比其他缓释阿片类药物,MorphaBond可以更好的抵抗切割,碾碎或其他工具所造成的破坏。当药物处于液体环境时,由于MorphaBond配方中含有一种粘性材料,容易堵塞针管而无法静脉注射,所以能够减少药物因粉碎、溶解后提取而发生的滥用。
图6. Inspirion 释药技术公司专利技术
中文名是羟考酮缓释胶囊,来自Collegium Pharmaceutical公司,于2016年4月26日获FDA批准上市,每天两次,用于严重到需要日常的、全天候的、长期阿片类药物治疗疼痛,替代治疗不能满足时使用。
Xtampza ER是一种羟考酮“胶囊内微珠”的新型缓释口服制剂,采用其专有的DETERx® 抗滥用技术平台开发,有效解决了常规使用方法造成的滥用问题,并设计通过维持其药物释放,控制疼痛。Xtampza ER胶囊内含有许多微珠,每一个微珠都经过标准的喷淋冷凝过程,羟考酮以脂肪酸盐的形式固体分散于由疏水性蜡质材料构成的高熔点缓释基质内。每个微珠均具有抗物理破坏和缓释的特性。微珠难溶于水中,因此可防止通过水溶的方式提取活性药物。
Collegium Pharmaceutical 公司根据前述的FDA2013年《产业指南草案》对产品进行了遏制滥用特性的研究。体外试验结果显示:在研磨、捣碎等多种剧烈的物理破坏方式下,Xtampza TM ER 的微珠仍然能够保持其颗粒完整性。破坏后的Xtampza TMER与完整胶囊相比在健康人体内的药动学参数近乎一致(90% CI: 80% ~125%) 。一个非依赖、娱乐性药物滥用受试者的口服滥用倾向研究结果显示:咀嚼后服下的Xtampza TM ER对受试者产生的最大药物喜欢作用(Drug Liking Emax)显著低于碾碎的羟考酮速释剂对照( P <0.000 1)。此外,Xtampza TM ER 制剂破坏后吸食产生的最大药物喜欢作用亦明显低于速释羟考酮制剂(P <0.000 1),可见本品对滥用者的吸引力明显较低。基于上述研究,Xtampza TM ER 被认为能够有效遏制通过口服、静注、吸食等多种途径的药物滥用。此外,由于每个微珠均具有缓释特性,其外在胶囊可以移除囊壳,撒在食物中,直接口服或者通过喂养管给药,且不影响其药物释放度、安全性及抗滥用特征,这也为吞咽有困难的患者带来了方便。
中文名是盐酸羟考酮/盐酸纳曲酮缓释胶囊,来自辉瑞制药,于2016年8月19日获FDA批准上市,用于需要日常全天候长期接受阿片类药物治疗的严重疼痛,以及用于其他替代方案不足以控制的严重疼痛的治疗。
Troxyca ER 是由阿片受体激动剂盐酸羟考酮和阿片受体拮抗剂盐酸纳曲酮组成的一种新型防滥用长效阿片类止痛药物,口服吸收时,纳曲酮处于隐藏状态,在羟考酮释放发挥作用后纳曲酮才缓慢释放,但如压碎破坏药物,纳曲酮会与羟考酮同时释放,从而达到防止滥用的目的。这款产品旨在阻止成瘾的人通过压碎药物颗粒经由口腔或鼻内途径滥用。Troxyca ER的防滥用特性在一连串的体外实验室研究和3个潜在滥用临床研究(利用压碎Troxyca ER通过口服或鼻腔途径给药以及模拟静脉注射途径)中得到了证实。需要注意的是,以滥用为目的或意外服用太多该药物可造成羟考酮过量,导致死亡。
8、Arymo ER
中文名是硫酸吗啡缓释片,来自Egalet Corporation,于2017年1 月9 日被美国FDA 批准上市,用于治疗足够严重、需要每天连续不断使用长效阿片药物治疗的疼痛。
Arymo ER采用Egalet公司专利技术Guardian™开发,这也是首个利用该技术开发最终获批的药物。该技术通过一种理化屏障,而不是使用阿片受体拮抗剂来达到遏制滥用效果。体外实验显示,相比不具有遏制滥用功能的硫酸吗啡碱缓释片,该药物抵抗各类工具切割、碾压和研磨的能力大大提升。因为这种特殊的理化性质,该药物很难被用于注射滥用。所以,Arymo ER的防滥途径包括所有三种途径,即口服、鼻吸入及静脉注射。
中文名是重酒石酸二氢可待因酮缓释片,来自仿制药巨头Teva公司,于2017年1月在美国FDA获批上市。适用于疼痛严重到需要日常的、全天候的、长期的阿片类药物治疗、以及采用其他镇痛药无法有效控制疼痛的管理,但该药不适用于仅在需要时临时服用。
Vantrela ER是继2014年Hysingla(氢可酮ER)批准后的第二个ER/LA氢可酮产品,该药采用梯瓦专利性的防滥用技术开发,即使用API颗粒进行包衣后再压片的产品,包衣材料为乙基纤维素和羟丙甲基纤维素,制成的药片不但可以抵抗压碎、溶剂提取,而且压碎后还具有缓释功能,Teva在配方中加入了高粘度成分山嵛酸甘油酯,可堵住针孔无法注射,达到防滥用的作用。
10、RoxyBond
中文名是盐酸羟考酮速释片,来自Daiichi Sankyo Inc,于2017年4月20日获美国FDA批准上市,用于治疗需要阿片类药物的中重度疼痛患者。
截至目前,CDER已经批准了10种具有旨在阻止滥用的性质的阿片类产品,但是除Roxybond之外的所有产品都是缓释/长效(ER/LA)制剂,Roxybond是FDA第一个获批的具有防滥用特性的速释(IR)阿片类药物。该药物采用多层包衣片剂的形式,通过物理及化学方法屏蔽以防滥用。实验数据显示,与其他速释阿片类止痛药物相比,RoxyBond在抵抗切割、挤压、研磨或工具破坏方面有着显著提升。此外,在多种条件下,RoxyBond药片可以抵抗家用或试验用溶剂,从而达到抗化学提取的效果。RoxyBond含有的粘性材料还可以使药物难以通过针头进行注射,并且使溶液配制变得更加困难。由此,Roxybond可以很好地阻止经静脉内和鼻内(鼻吸)途径的滥用。
由此,我们期待,随着防滥用阿片类药物研发指南的发布,更多的防滥用阿片类药物能够获批上市,全民关注的阿片类药物滥用问题能得到有效缓解。
作者微信:youxuanzibenlifang
过往文章:
参考文献:
[1] KIRSH K,PEPPIN J,COLEMAN J.Characterization of prescription opioid abuse in the United States: focus on route of administration[J].J Pain Palliat Care Pharmacotherapy,2012,26 (4) :348-361.
[2] United Nations Office On Drug And Crime/World Health Organization.Opioid overdose: preventing and reducing opioid overdose mortality[EB/OL].[2013-06-07].
[3]FDA. Abuse-Deterrent Opioids — Evaluation and Labeling, Guidance for Industry.April 2015.
[4] FY2013-2017 Regulatory Science Report: Oral Abuse-deterrent Opioid Products.
[5] MASTROPIETRO DJ,OMIDIAN H.Abuse-deterrent formulations: Part 2: commercial products and proprietary technologies[J].Expert Opinion Pharmacotherapy,2015,16( 3) :305-323.
[6] BUTLER SF,CASSIDY TA,CHILCOAT H,etal.Abuse rates and routes of administration of reformulated extended-release oxycodone: initial findings from a sentinel surveillance sample of individuals assessed for substance abuse treatment[J].J Pain,2013,14( 4) :351-358.
[7] SEVERTSON SG,BARTELSON BB,DAVIS JM,etal.Reduced abuse,therapeutic errors,and diversion following reformulation of extended-release oxycodone in 2010[J].J Pain,2013,14 ( 10) :1122-1130.
[8] REIMER K,HOOP M,ZENZ M,etal.Meeting the challenges of opioid-induced constipation in chronic pain management-a novel approach[J].Pharmacology,2009,83( 1) : 10-17.
[9] BLAGDEN M,HAFER J,DUERR H,etal.Long-term evaluation of combined prolonged-release oxycodone and naloxone in patients with moderate-to-severe chronic pain: pooled analysis of extension phases of two Phase III trials[J].Neurogastroenterol Motil,2014,26( 12) : 1792-1801.
[10] KATZ N,SUN S,JOHNSON F,etal.ALO-01(morphine sulfate and naltrexone hydrochloride) extended-release capsules in the treatment of chronic pain of osteoarthritis of the hip or knee:pharmacokinetics,efficacy,and safety[J].J Pain,2010,11(4):303-311.
[11] Johnson FK,Stark JG,Bieberdorf FA,etal. Relative oral bioavailability of morphine and naltrexone derived from crushed morphine sulfate and naltrexone hydrochloride extended-release capsules versus intact product and versus naltrexone solution:a single-dose,randomized-sequence,open-lable,three-way crossover trial in healthy volunteers[J].Clin Ther,2010,32(6):1149-1164.
[12] Collegium Pharmaceutical,Inc.DETERxTM Technology Platform [EB/OL].2015-05-29.
[13] KOPECKY EA,FLEMING AB,NOONAN PK,et al.Impact of physical manipulation on in vitro and in vivo release profiles of oxycodone DETERx: an extended-release,abuse-deterrent formulation[J].J Opioid Manag,2014,10( 4) :233-246.
[14] COLLEGIUM PHARMACEUTICAL,INC.Collegium Pharmaceutical releases positive top-line results of oral human abuse potential ( HAP) study with oxycodone DETERx,and abuse-deterrent,extended-release product[EB/OL].[2014-11-17].
发布者:药时代,转载请首先联系contact@drugtimes.cn获得授权

 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
