“
上周我们在上海和劲松总闲聊时提及NASH,意犹未尽。正好本周五要参加他们主办的中国NASH大会,所以我们提前把这篇文章发出来,也算给大家暖暖场,热热身。
”
2016年9月艾尔建17亿美元收购Tobira,扩充NASH管线。
2016年11月吉利德4亿美元的预付款,8亿美元的里程碑付款收购NDI-010976项目。
2017年5月诺华公司加强了对NASH的研发投资组合获得由Conatus开发的处于中期临床的NASH药物emricasan。
2018年3月再生元(Regeneron)与Alnylam宣布达成合作,以开发用于治疗非酒精性脂肪性肝炎(NASH)和其它相关疾病的RNAi疗法。
2018年10月辉瑞、诺华宣布将共同开发NASH组合疗法。
2018年11月罗氏收购Jecure 获得整个NLRP3抑制剂产品线。
若按照单一适应症进行研发热度的统计,NASH(非酒精性脂肪型肝炎)毫无疑问是工业界最热门的焦点。包括数家巨头在内的上百家药企竞相开发,五花八门的靶点各显其能,超过30个药品进入临床阶段,上百个临床试验同时展开,数以千计的患者被招募其中,在这些竞争者中不乏中国生物科技公司的影子。在这一片火热之中我们更应该冷静的去对项目的靶点MOA和数据细节进行考察,而不是按照焦点或赛道进行所谓的布局,毕竟Rapastinel和Esketamine同靶不同命的结局就近在眼前,更遑论在五花八门的机制中做出选择。本文将根据以往的学习和项目经验对NASH做出一番梳理。
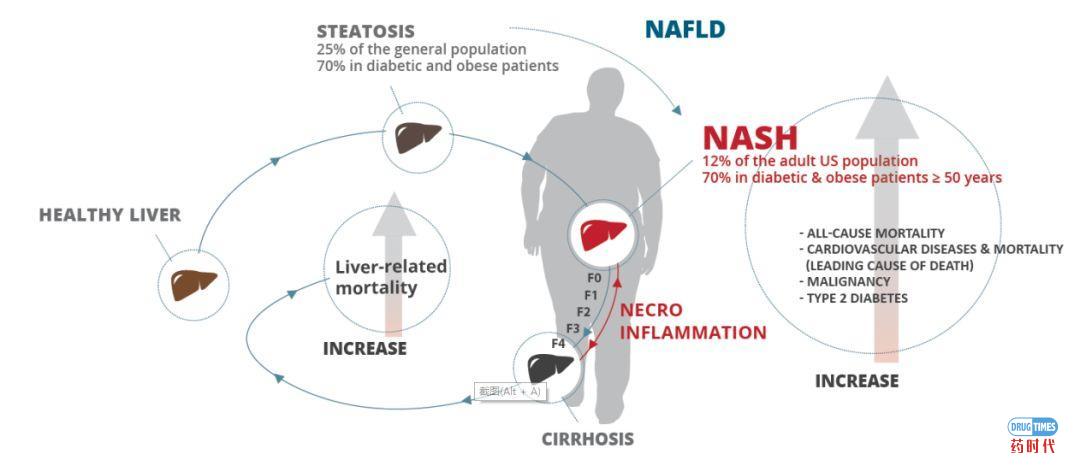
NAFLD(非酒精性脂肪性肝病)正在无声无息的影响着地球上大量患者的生活。老龄化的加剧,肥胖和2型糖尿病患者人数的升高与一些其他相关因素的恶化导致NAFLD在过去的数十年里的发病率爆发式的增长。尽管患者人数庞大,但NAFLD依然是一个新兴的陌生领域,人们对它的机制研究,诊断,治疗甚至对其危害的认知依然有很多不足之处。
首先我们需要认识到NAFLD是一类症状相同的适应症的集合,其背后的致病机制可能相当复杂。
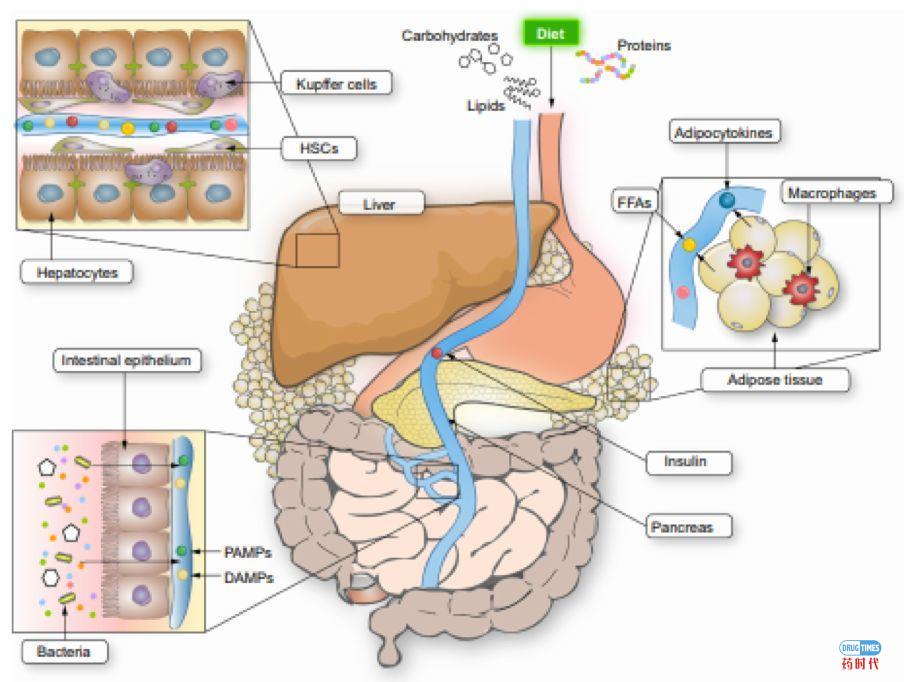
(图片源自:EASL)
从名字就可以看出,NAFLD的特征主要是脂肪在肝脏中的过度堆积。堆积的脂肪与其他诸如胰岛素抵抗等因素联合作用,使得肝脏承受了较大的代谢与氧化压力,有时可能会引起持续的慢性炎症反应,炎症反应标志着NAFLD进入NASH阶段。
可以说NASH是属于NAFLD的一个子集或者说恶性进展阶段,其主要特征是慢性炎症和随之而来的肝细胞凋亡。如果NASH在这个阶段得不到控制,受损伤的肝细胞死亡之后,肝脏会启动自身的损伤修复机制,用来补充死亡的肝细胞,纤维化则是伴随肝脏损伤修复过程的生理反应。由于慢性炎症与过度负荷导致的肝脏代谢毒性会持续导致肝细胞死亡,肝纤维化过程就会一直存在并且累积,而累积的肝纤维化最终引起肝硬化。NASH和肝细胞纤维化在早期并无明显的症状,当出现明显症状的时候,基本上已经发展为中晚期肝硬化。
(图片源自:EASL)
目前NASH还没有一个公认可靠的诊断方式,主要依赖肝穿刺进行病理确认。目前NASH进程主要通过包含脂积存,炎症和细胞气球样变性的NAS评分,以及纤维化评分来判断。
NAFLD是发达国家第一大慢性肝病及肝酶异常的首要原因,在不同的地区普通成年人的患病率为15%-30%,以美国为例,NAFLD与NASH患者总数达到8000万人,其中约1500万人为NASH患者。NASH患者在10年内有20%左右的几率进展为肝纤维化导致的肝硬化。肥胖和2型糖尿病与NASH的疾病进程有莫大关联,约60%以上的2型糖尿病患者患NAFLD,其中三分之一属于NASH。但也有研发发现,NASH在没有糖尿病合并症的NAFLD患者中也占有很大比例。
NASH是少数没有任何标准疗法的常见病之一,这也是工业界愿意进行巨额投资的唯一原因。2014年,德意志银行发布报告,预测全球NASH治疗药物市场的规模到2024年将超过300亿美元。EvaluatePharme则预测全球NASH药物的市场规模在2025年可以达到400亿美元。
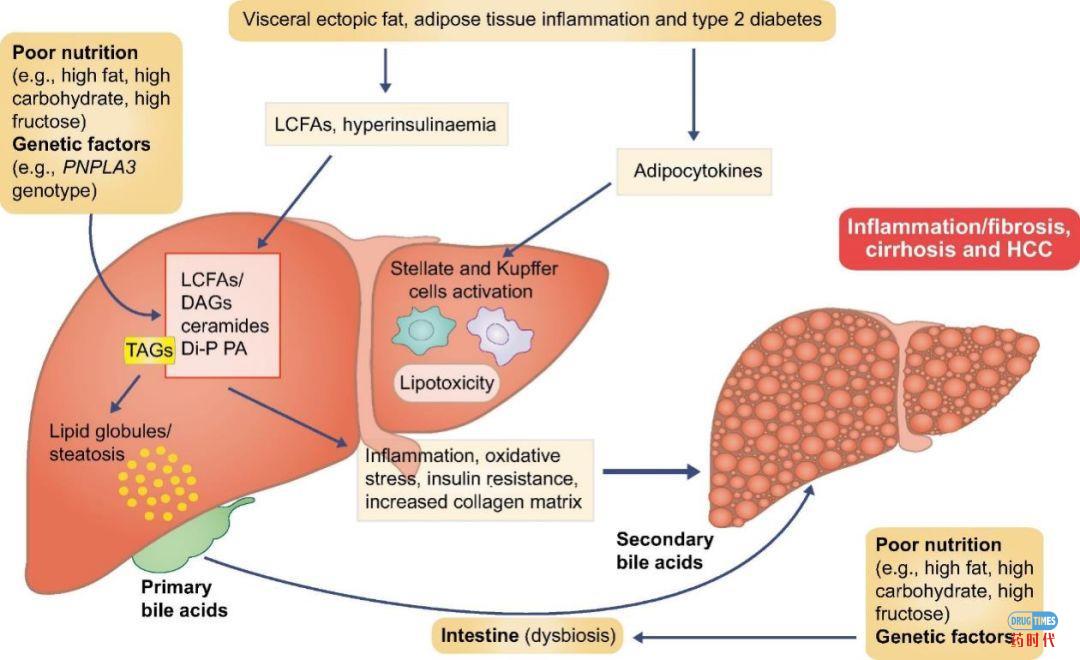
NASH目前最广泛接受的病理解释是二次打击假说(2 hit hypothesis)。肝脏中脂类(lipid)的堆积及脂肪堆积带来的胰岛素抵抗(Insulin resistance)是一次打击;在一次打击的基础上,多种细胞因子或炎症因子介导的脂肪酸的过氧化所导致的炎症和氧化应激反应形成二次打击,最终导致NASH出现。
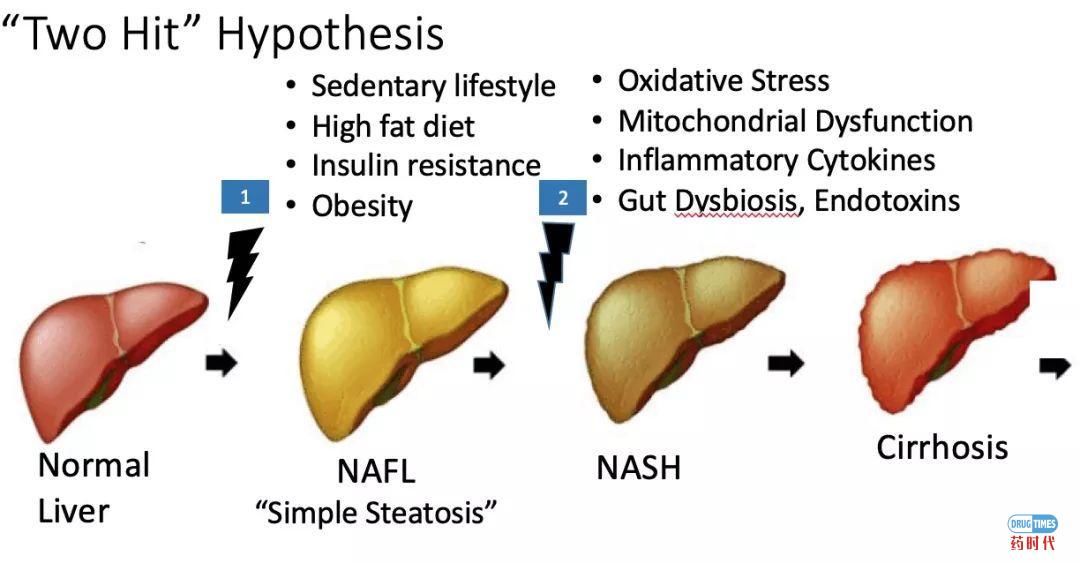
目前普遍认为氧化压力及其导致的脂质过氧化,促炎细胞因子,脂肪因子,线粒体功能失调是最常出现第二次打击。虽然二次打击假说对于我们观察到的病理现象做出了比较有说服力的解释,但与我们得到的临床统计学结果仍有不少相互矛盾地方。
一般来说脂类在肝部的堆积和胰岛素抵抗与肥胖呈正相关关系,肥胖还会增加炎性因子的释放,让体内长期处于一种炎症反应状态。若二次打击假说完全成立,那么我们应该观察到的临床统计学结果应该如下:
(1)肥胖个体更容易患有NAFLD;
(2) 肥胖个体的NAFLD更容易进展为NASH并且NAS评分更高;
(3)更高的NASH发病率和NAS评分使得肥胖个体更容易进展为肝硬化(晚期纤维化)。
《Am J Gastroenterol》杂志2015年文章显示在美国核磁共振检查BMI小于25(701例)的人群中有19%患有NAFLD,并非显著低于超重(BMI大于25但小于30)和肥胖人群(BMI大于30)。
日本东京女子医科大学的Maki Tobari等于2018年在《J Gastroenterol Hepatol》发表了依据人体质量指数(BMI)和性别分层对日本NAFLD患者进行了评估结果。结果显示NASH患者中瘦人(BMI小于25)轻度脂肪变性患病率较高。晚期纤维化的发生率在男性和女性之间存在显著差异,晚期纤维化发生率在肥胖男性中更高(瘦人:31.0%,超重患者:41.6%,肥胖患者:60.9%;P<0.01),但在严重肥胖女性中则较低(瘦人:51.4%,超重患者:62.9%,肥胖患者:33.7%;P<0.01)。
《J Clin Med》也于2018年12月刊登了一篇NAFLD的统计学结果,研究者根据体质量指数(BMI)对466名确诊为NAFLD的欧洲患者进行活检和临床资料分组。结果显示瘦人NAFLD患者的小叶炎症发生率高于超重患者(16.2% vs. 7.9%,P=0.011),但与肥胖患者相似(16.7%)。与瘦人(25.7%,P=0.014)和肥胖(25.3%,P=0.006)患者相比,超重患者较少观察到气球样变(15.7%)。重患者相比瘦人(25.7%,P=0.019)和肥胖(24.7%,P=0.016)患者,有更低的门静脉及周围纤维化发生率(13.2%)。瘦人患者的肝硬化发生率(8.1%)高于超重(1.7%,P=0.010)和肥胖(2.0%,P=0.027)患者。总计60名(12.9%)被诊断患NASH,相比于超重患者(8.3%),瘦人(18.9%,P= 0.01)和肥胖(17.3%,P=0.007)患者的NASH率更高。
以上结果表明似乎NASH的发生与进展似乎与更高的脂类堆积,更高的炎症因子水平并无直接关系。若我们对NASH病人的肝纤维化进行一个更细致的观察我们会发现:在不治疗的情况下NASH病人肝纤维化进展/稳定/消退的病人大约各占33%,似乎NASH可能并不是肝硬化的主要诱因?
以上种种都预示着我们对NASH病理学解释的肤浅。
因为对NASH背后机制认识的不完全,NASH药物的开发其实是一个摸着石头过河的过程。
目前工业界临床管线的靶点选择思路大致遵循了2次打击假说的轨迹。现阶段开发NSH适应症的公司在选取靶点方面基本全部是从代谢,炎症,纤维化3个方面入手,当然部分靶点可以同时作用于两方面。
代谢类的靶点还可以细分为三个小类分别是:
(1)脂代谢相关靶点,例如PPARα/ δ激动剂,TRβ 受体激动剂,ACC抑制剂,ANGPTL3抑制剂,FGF-21类似物等;
(2)葡萄糖代谢相关靶点,例如PPARα/ δ激动剂,GLP-1,果糖酶抑制剂,SGLT-2抑制剂,mTOR增敏剂;
(3)胆酸类相关靶点,例如FXR抑制剂,FGF-19类似物。炎症靶点则包括了氧化压力,炎症和免疫系统多方面的靶点,包括ASK-1,TLR-4,CCR2/5,Caspase抑制剂,AOC3抑制剂,NKT细胞抑制剂等。
抗纤维化方面的靶点则相对较少,进入临床的包括CCR2/5,ASK1,Caspase,5-LO等。其中进展最快的分别是Intercept的FXR激动剂,Genfit的PPARα/ δ激动剂和艾尔健的CCR2/5抑制剂。
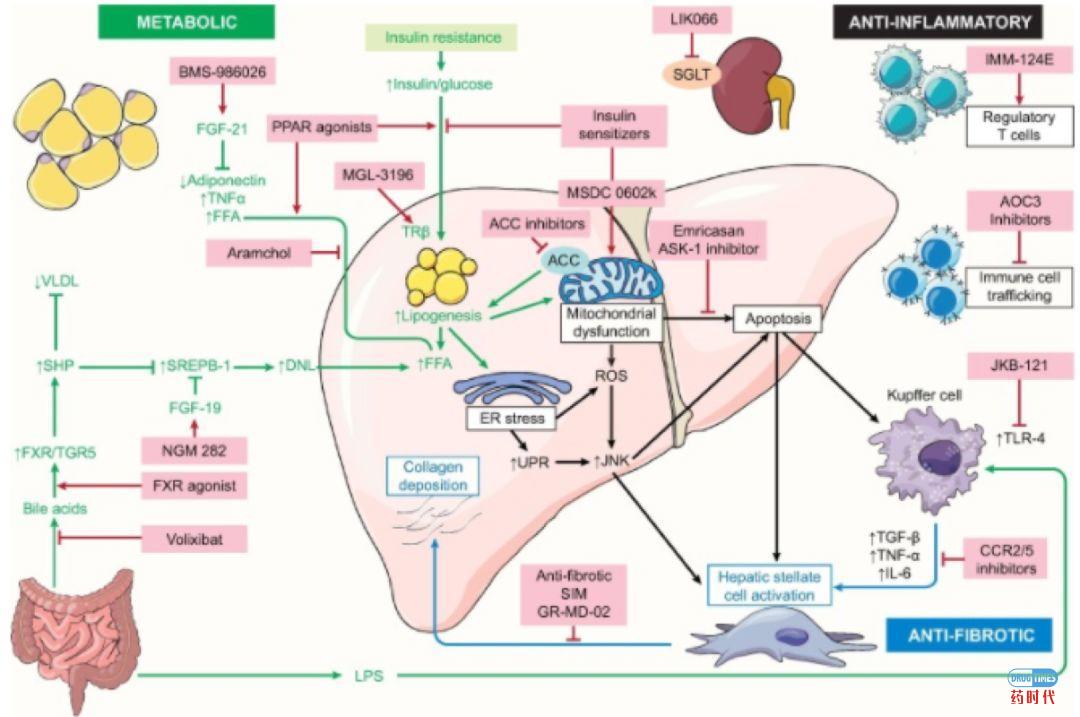
(图片源自:EASL)
今年2月Intercept宣布旗下的FXR激动剂奥贝胆酸(OCA)针对F2-F3级肝纤维化的NASH患者的3期REGENERATE研究的期中分析取得阳性结果。肝纤维化程度至少改善1级且NASH没有恶化的患者比例在高剂量组(25mg/d)达到统计学显著意义(23.1% vs 11.9%,p=0.0002)。NAS评分改善且纤维化程度没有恶化的患者比例未达统计学显著意义,但有改善趋势。10mg/d的低剂量组(OCA PBC适应症获批计量)未能达到以上任何一个终点。最常见的不良事件与奥贝胆酸PBC临床试验中的结果一致,主要是剂量相关的瘙痒,在安慰剂组和奥贝胆酸10mg, 25mg组的发生率分别为19%,28%和51%。大多数瘙痒事件为轻至中度,重度瘙痒在3组的发生率分别为<1%,<1%和5%。但值得注意的是高剂量组瘙痒而出组的患者比例为9%。
Genfit的PPARα/ δ激动剂Elafibranor也将于今年三季度公布三期临床数据。Elafibranor三期临床的主要终点选取的是NAS评分改善且纤维化程度没有恶化的患者比例。从二期临床结果来看Elafibranor在NAS缓解方面并不比OCA出色(NAS≥4,19% vs. 9%, OR=3.52, 95% CI [1.32-9.40], p=0.013)。考虑到OCA在三期临床中错失了这个临床终点,Elafibranor的未来并不算乐观。
艾尔健的CCR2/5抑制剂Cenicriviroc目前也在三期临床阶段,选取的临床终点为肝纤维化程度至少改善1级且NASH没有恶化的患者比例。Cenicriviroc在2B临床试验中并未到达临床终点。2018年艾尔健公布了Cenicriviroc 2B临床试验2年期的追踪结果,显示对比安慰剂,Cenicriviroc组有着更高的肝纤维化程度至少改善1级比率(39% vs. 29%),但此结果依然远逊于OCA的2期临床中同一终点的表现。
除此以上几个靶点以外目前表现出较好潜力的靶点当属GLP-1和THR-β。THR-β在一个2018年结束的2期临床试验中在NAS消减方面取得了优于OCA的效果,但此结果是基于MRI-PDFF评估的结果,可能与金标准有所差别。GLP-1则是通过Liraglutide在一个小型2期临床中验证了其机制,相比安慰剂组(n=26),Liraglutide治疗组(n=26)出现组织学缓解的患者比例显著提高(39% vs 9%),发生肝纤维化进展的比例远低于安慰剂(9% vs 36%)。目前诺和诺德也在推进Semaglutide的NAFLD临床试验。相信不远的将来,在先前临床试验中神挡杀神佛挡杀佛的Semaglutide也会在NASH竞争中锋芒毕露。
目前开发NASH的国内生物技术企业在20家左右。最常见的靶点是FXR和GLP-1,其中有超过6家扎堆在FXR激动剂,另有至少5家企业聚集在GLP-1靶点上,其他比较常见的靶点包括FGF21和ASK1(随着Gilead ASK1的三期临床失败,布局ASK1的企业目前看来凶多吉少)。进度最快的分别是众生药业的ZSP1601和上海拓臻的FXR激动剂,均处于1期临床阶段,除了上述两家以外诺华的FXR激动剂LMB-763也在国内开始了2期临床。
当以投资人的视角来审视国内NASH项目时除了平常经常遇到的靶点雷同的问题外,还面临着其他几方面的挑战。最大的挑战来源于药效模型种类很多。
国内公司各自使用不同模型进行药效学实验造成在项目之间很难直观的相互比较,这就对项目质量评价带来的很多模糊的空间。当然首先我们要承认老鼠是天然不存在NASH这么一个疾病的,各个模型仅能一定程度上模拟NASH的症状,其背后的机理可能和人相差十万八千里。目前唯一取得三期阳性结果的OCA在临床前实验中使用了如下4种动物模型:
1、C57BL/6老鼠高脂高胆固醇高果糖饲养模型—这个模型相对比较理想,可以稳定构建出NAS>5的动物,为一个问题在于构建时间过长(大于30周);
2、C57BL/6老鼠高脂高胆固醇高蔗糖饲养模型—NAS评分非常低;
3、ob/ob老鼠高脂高胆固醇高蔗糖饲养模型—相对于正常老鼠构建速度更快,纤维化更严重;
4、foz/foz老鼠高脂高胆固醇饲养模型—很快出现空腹高血糖,三个月即可完成动物模型构建。脂代谢与ob/ob和正常老鼠有所不同。
我们相信以上4种模型在现阶段也是最有说服力的模型。除了模型种类带来的问题外,目前所有老鼠模型在国内均无法进行biopsy来确定模型在给药之前的疾病状态。换句话说,在给药时我们根本不知道老鼠到底是处于NASH状态还是仅仅有NAFLD,这对评价临床前项目质量也带来了很大的困扰。此外国内还有部分CRO提供患有NASH的老年灵长类动物模型,不过此模型花费极高,一个灵长类的NASH药效学实验费用直追1期临床。
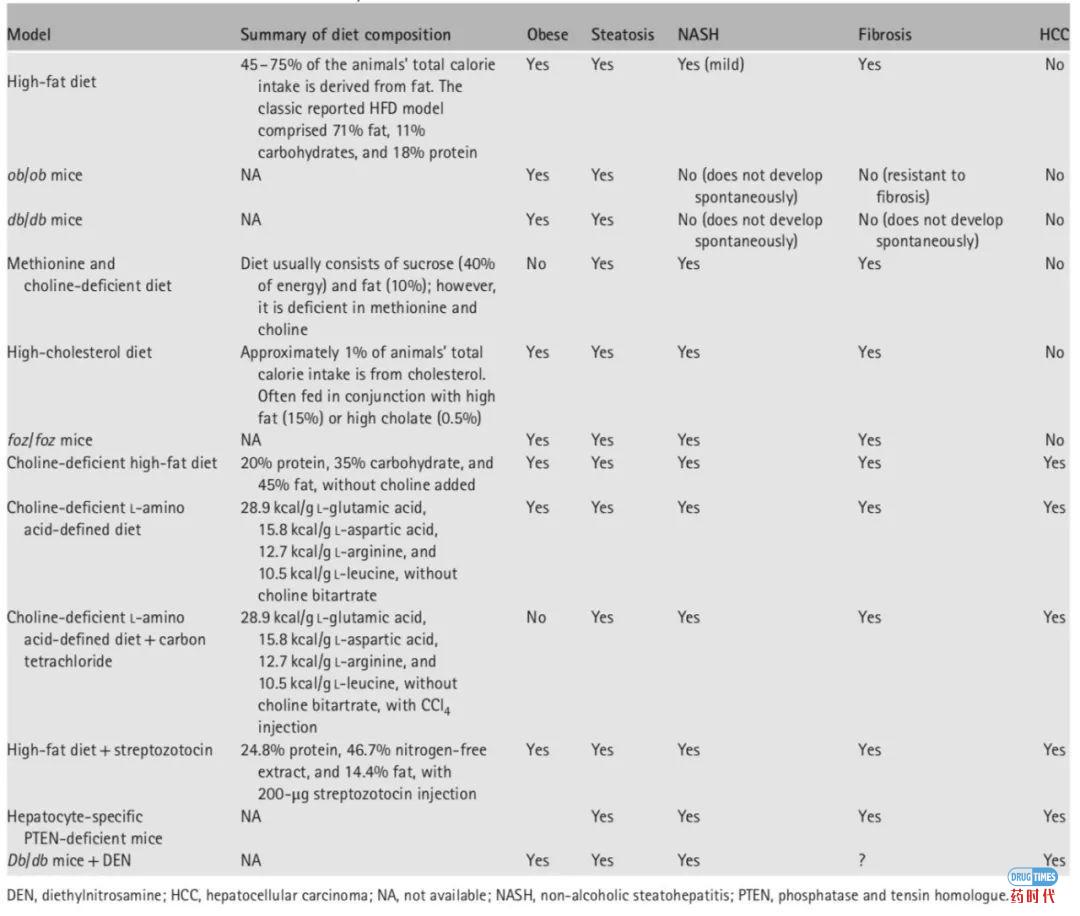
(NASH临床前动物模型一览表)
在不同动物模型中NAFLD和NASH发病机制不一样。比如在NAFLD中,致病机制包括增加新生脂肪生成,脂肪组织脂肪分解增加,膳食FFA水平增加,β-氧化受损和VLDL合成受损, 这些都导致肝脏甘油三酯积累并最终导致NAFLD。
db / db小鼠和ob / ob小鼠模型由于增加了新生脂肪生成和IR,而发展成为NAFLD。而喂食HFD的小鼠由于膳食FFA水平增加也可以发展为NAFLD。
在NASH中,脂肪变性进展为脂肪性肝炎的两种主要机制是氧化应激和促炎细胞因子的增加。 喂食MCD饮食的小鼠由于氧化应激增加而发展为NASH,而喂食高胆固醇饮食的小鼠也可以由于氧化应激和促炎细胞因子的增加而发展为NASH;另外,由于肥胖诱导的IR,foz / foz小鼠同样可以发展为NASH。(见下图)
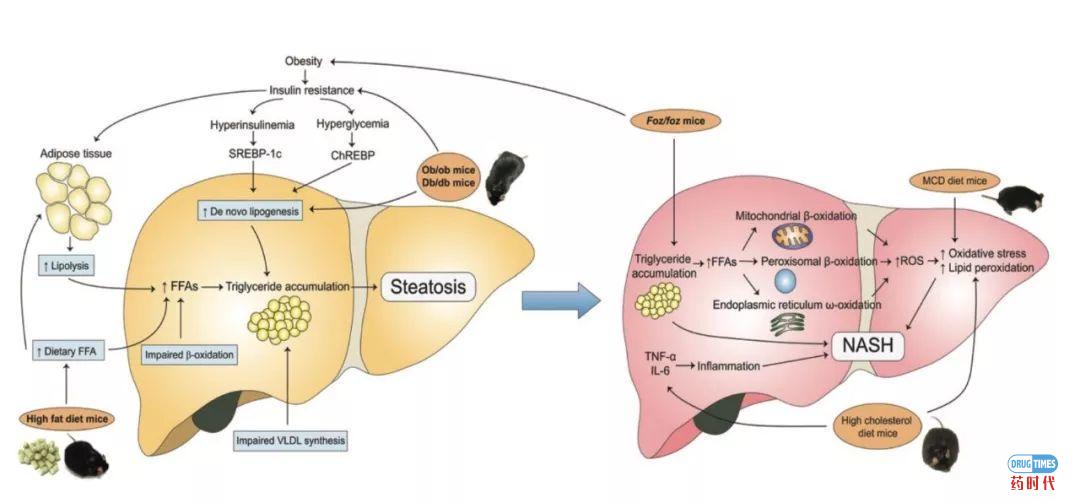
(四种动物模型发展为NAFLD或NASH的致病机理)
其他挑战还包括各个项目提供的药效数据仅限于NAS缓解和纤维化的缓解,经常性的缺少对各个PD biomarker的检测。一般来说国外最常用的PD biomark包括纤维化方面:COL1A1/COL3A1/TIMP1/MMP2;脂代谢方面:LCAD/IDH1/CPT2/ACOX1;炎症方面:CD68/TGFB1/CCR2/MCP1。
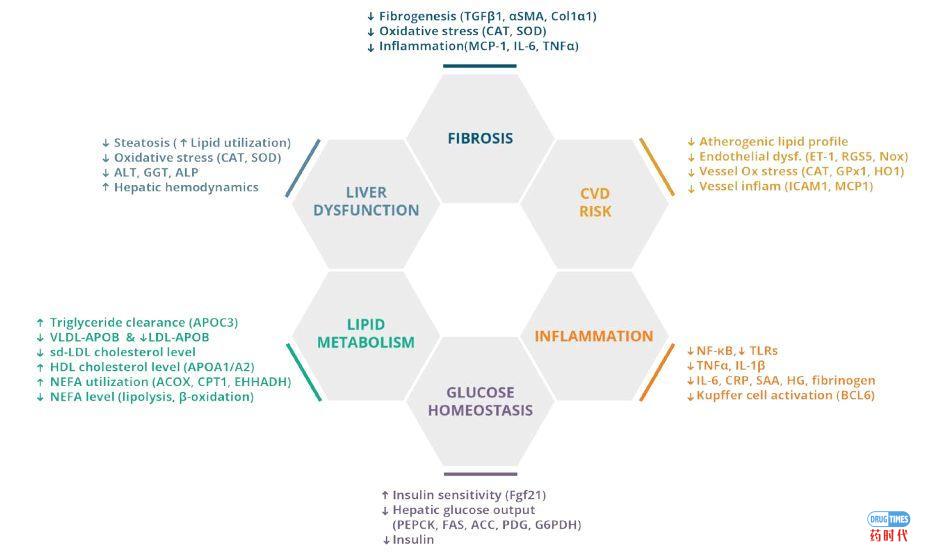
(NASH疾病六个维度的相关biomarker,注意:不是PD biomarker)
以上就是本文的大致内容,最后总结一下我们对NASH的看法:
(1)总体来说NASH药物的开发依然属于风险很高的领域。虽然其底层机制并不明确,但是工业界目前处于临床/临床前阶段的几十个五花八门的靶点将有很大概率在未来5-10年一定程度上的解决问题。只不过这将是一个少数人获益匪浅而多数人血本无归的游戏。
(2)现阶段看来纤维化缓解目前已经一定程度上的实现,未来能缓解NAS评分的项目比缓解纤维化更有意义(在这不考虑抗纤维化药物的多适应症潜力)。
(3)按照NASH病因的复杂程度和临床结果来看联合用药将是大势所趋,OCA有很大几率成为NASH领域联合用药的基石,未来不同机制的联用药品,尤其是可以缓解NAS评分补足OCA不足的项目,将有更高的商业价值。
(4)监管机构对于慢性代谢类疾病安全性的要求向来是各个疾病领域最高,未来应用到NASH也丝毫不奇怪。考虑到NAFLD和NASH患者有很高的几率并发其他疾病,例如糖尿病,肥胖等,未来监管机构对于药物副作用的考察必定十分严格。对于现阶段仍处于临床前的项目对于其副作用方面的考察我们认为应该向糖尿病靠拢。安全性较差的药物即便侥幸上市,随着更安全的竞品陆续上市,其生命周期可能比其专利其更短。
(5)跟很多生物科技公司的交流中我们发现,很多公司低估了临床入组的难度,对于临床进度过于乐观。
(6)2025年400亿美金的NASH药品市场规模过于乐观,目前NASH的确诊方式严重的影响着病人的入组和潜在市场规模。除非我们能看到基于生物标记物或影像学的确诊方式,否则400亿市场不过是水月镜花。在我们看来NASH市场完全发挥其潜力的最低要求则是我们可以通过无创手段确认哪些人群是高危病人。
作者微信:gypgypgypgai

以上文字由Biotech venture capital原创,仅为促进讨论与交流,不构成法律意见或咨询建议。版权所有,违者必究。如需转载,请注明作者和Biotech venture capital原创。
参考:
1、Animal models of non-alcoholic fatty liver disease: current perspectives and recent advances
2、《J Gastroenterol Hepatol》
3、《Am J Gastroenterol》
4、《J Clin Med》
5、Clinical Practice Guidelines Non-alcoholic fatty liver disease
过往文章:
发布者:药时代,转载请首先联系contact@drugtimes.cn获得授权

 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
