
代表建议/议案:
“为进一步加快创新药上市,优化审评审批流程,建议1)落实《药品注册管理办法》,改“串联”为“并联” ;2)进一步完善IND沟通交流会申请制度; 3)进一步提高项目审评沟通效率。”
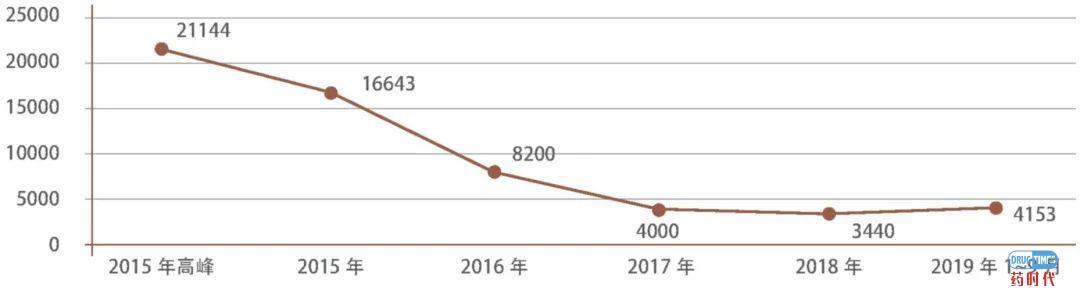
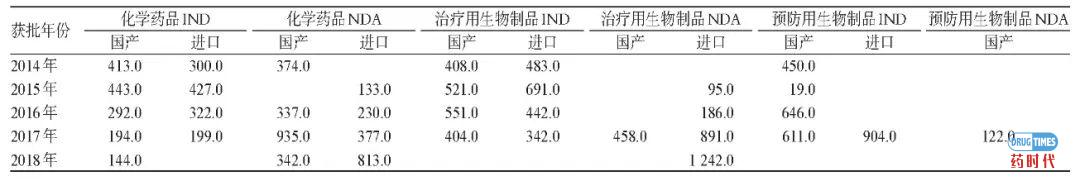
代表建议/议案:
提交《关于进一步优化人类遗传资源审批流程的建议》。
全国人大代表、烟台荣昌制药股份有限公司董事长王威东:
全国政协委员、北京大学第一医院儿科教授丁洁:
药品专利期限补偿制度
代表建议/议案
“建立医药产业的专利补偿机制,对促进新药研发也至关重要。因为我国新药的审评审批时间较长,一个新药从研发到上市可能就已经把专利期用掉了一半以上,根据发达国家经验,建议我国的新药专利期从20年延长到25年。”
“要加强知识产权保护,尤其要延长创新药专利保护期及加强创新药数据保护,国家强调这个问题已经很长时间了,也正在积极推动,但近几年确实还没完全落地,有关部门需要结合实际情况考虑如何加快知识产权制度落地,出台一系列细则,给整个医药创新注入活力。”
其他热点议案
全国人大代表、人福医药集团董事长李杰
“完善鼓励供应链上游能力的建设,医药创新应提高到国家战略位置。”
参考资料:
1、孔繁圃.药品审评改革进展情况[J].中国食品药品监管,2019(11):30-39.
3、中华人民共和国国务院. 中华人民共和国人类遗传资源管理条例[2019]. http://www.gov.cn/zhengce/content/2019-06/10/content_5398829.htm
4、练茂荣.药品专利保护期限的延长及与“Bolar”例外之间的利益平衡[D].西南政法大学, 2014.
版权声明:文中图片取自网络,根据CC0协议使用,版权归拥有者。
任何问题,请与我们联系。衷心感谢!
– END –
本文为投稿作品,欢迎朋友们投稿,详情请见:

发布者:药时代,转载请首先联系contact@drugtimes.cn获得授权


 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
