欢迎参加2020中国NASH大会!
GV-971 甘露特钠胶囊 九期一 月2日于中国获批上市,用以治疗轻度至中度阿尔茨海默病 AD 准可以直接进入国际多中心III期临床试验的药物,GV-971倍受瞩目与期待。 研究表明,GV-971主要作用机理是重塑肠道菌群平衡,通过“菌群-肠-脑轴 肠-脑轴
本文试图由“繁”(线)至“简”(点),平行简介“菌群-肠-脑轴”在糖尿病认知障碍发生发展中的病变和作用,及GV-971靶向“肠-脑轴”改善及延缓AD小鼠的脑病变及认识障碍的关键/独特研究过程与发现,供作者和读者学习、比较、思索;作者文末对基于“肠-脑轴”进行药物开发的普适性、拓展性与挑战提出个人见解,供同仁参考。 (此类研究为当下热点,相关文献、评论海量。建议愿意钻研的读者“烧脑”阅读原创研究和综述文章探索奥秘)
人及动物肠道菌群/肠道与脑存在着密不可分的双向沟通和影响关系,当其中任何一方发生异常或病变,可以导致另一方出现异常或病变。这种内外关联体系,被称为“菌群-肠-脑轴”(Microbiota gut brain axis,MGBA),或简称为“肠-脑轴”(Gut-brain axis,GBA)。
“菌群-肠-脑轴”在糖尿病导致的认知衰退中的变化与作用
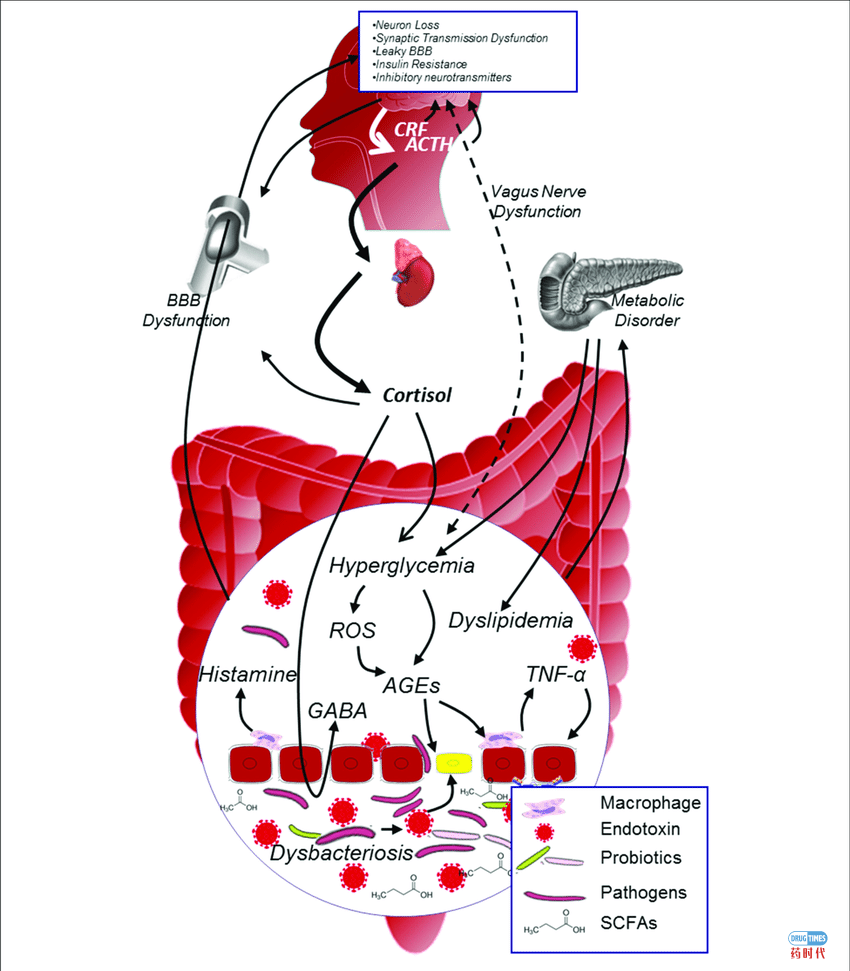
高达40%的糖尿病患者晚期出现糖尿病认知衰退 DCI 1)肠端:因糖尿病,肠道会出现以下三个主要病理变化: (1)肠菌群紊乱:导致糖尿病发生的主要原因之一高糖高脂饮食/饲料将引起肠道菌群失调 (2)肠内毒性物质增多,有益产物减少; 当肠道菌群紊乱后,则引发:
肠道内毒素(endotoxin)脂多糖(lipopolysaccharide,LPS)的释放增多,它是革兰氏阴性菌细胞壁主要组成成分,因肠道环境改变造成细菌死亡而释放,它可损伤肠粘膜,进入血液,导致组织器官炎症甚至内毒素血症 (endotoxemia)。
短链脂肪酸(Short chain fatty acid, SCFA)减少,其对机体的有益作用降低甚至消失。SCFA的主要作用涉及维持肠壁能量来源,调节机体能量平衡,促进PYY、GLP-1和GLP-2分泌,抑制炎症,降低胰岛素抵抗,保护脑神经细胞,维持神经递素正常分泌,影响学习、记忆等认知功能。
肠屏障(Gut barrier)损伤:当肠道菌群失衡后,肠道内病原体和内毒素增多,同时糖尿病高血糖和高血脂亦导致机体组织活性氧类(ROS)及晚期糖基化产物(AGEs)增加,所有这些毒性物质或促炎分子将导致氧化应激反应(oxidative stress),后者进一步诱导肠道巨噬细胞(macrophage)释放各种炎性因子如组织胺(histamine)、TNF-a等,导致肠细胞发生炎症反应,损伤肠粘膜(屏障),使得肠粘膜通透性增加,成为“漏肠”(leaky gut)。
以上环节在疾病发展中构成一个不断加剧、恶化的“菌群紊乱-肠屏障损伤-毒性物质进入机体”致病因果负作用循环。
2)脑部:器质及功能损伤导致“糖尿病认知衰退(DCI)” (1)血脑屏障 (2)脑神经细胞及功能损伤:由于BBB屏蔽作用降低,大量来自肠菌群及体内生成的毒性物质随血循环进入脑内,诱发脑内微环境失衡,造成炎症、脑细胞凋亡,最终导致脑神经细胞损失、神经突触传导异常、抑制性神经递质分泌异常及胰岛素抵抗。同时,伴随肠道菌群失调,肠道SCFA生成减少,其神经保护作用消减,将进一步造成脑神经细胞损伤及功能紊乱,最终导致“糖尿病认知衰退(DCI)”。 3)肠-脑链接系统(双向沟通路径): “肠-脑轴”通过血液循环及外周神经系统实现双向调节,毒性物质亦通过其传递。由下(肠)而上(脑)的调节已在上面描述。由上(脑)而下(肠-菌群)的调节,下丘脑-垂体-肾上腺(hypothalamic pituitary adrenal axis,HPA)轴在DCI发生中,发挥重要作用。HPA因糖尿病代谢紊乱而过度活跃时,产生过量促肾上腺皮质激素释放因子(Corticotropin releasing factor, CRF),形成皮质醇增多症(hypercortisolism),进一步导致机体代谢、肠功能、肠道菌群紊乱。
这是”脑与内分泌紊乱-肠和菌群紊乱”的致病因果负作用循环。
图1. “菌群-肠-脑轴”异常导致糖尿病认知衰退(DCI)机理
靶向“菌群-肠-脑轴”治疗阿尔茨海默病:GV-971作用机理
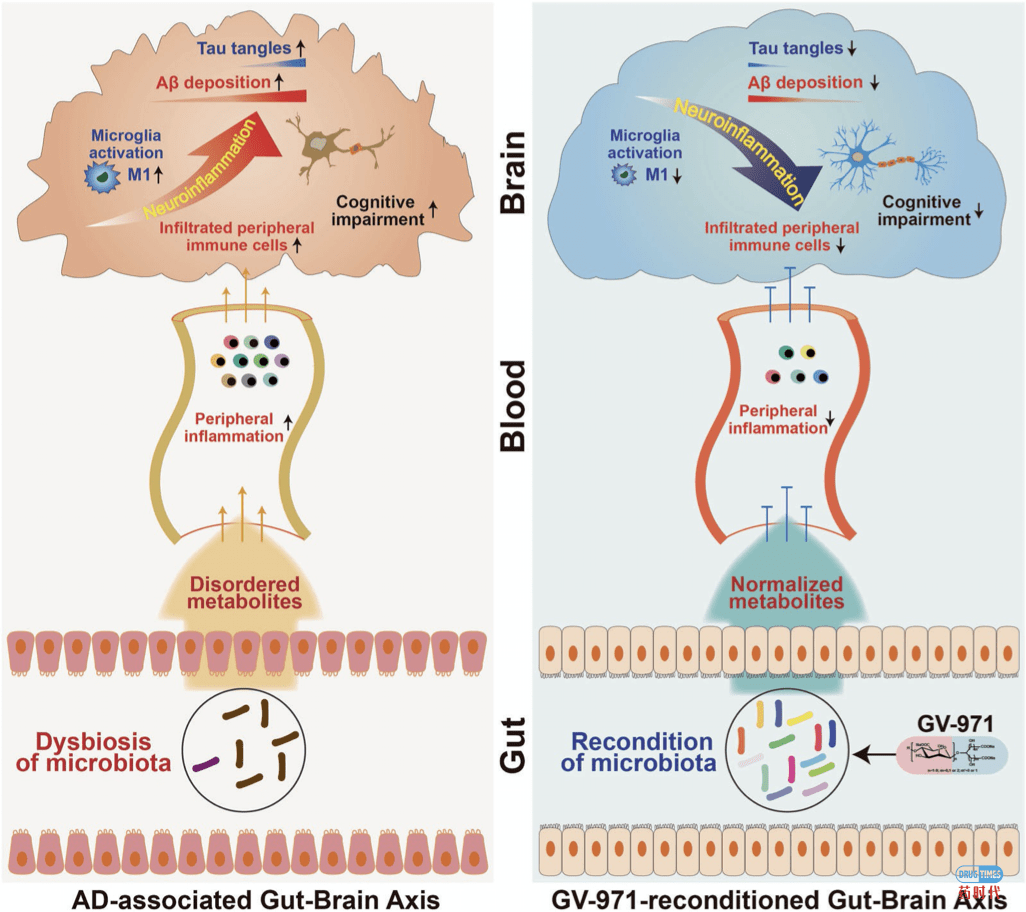
阿尔茨海默病(Alzheimer’s disease, AD),俗称老年痴呆症,是一种神经系统退行性疾病。病理特征为患者大脑皮层和海马体中β淀粉样蛋白(β-amyloid,Aβ)增多并沉积,形成老年斑(Plaque) ,及Tau蛋白在神经细胞内过度磷酸化,形成神经纤维缠结(Neurofibrillary Tangles,NFTs),二者造成神经元细胞功能退化、最终凋亡,同时伴随胶质细胞增生。神经炎症活化为主要分子特征。患者随病情发展,记忆、思维及其它重要认知功能进行性下降,表现出不同程度痴呆症状,并且出现运动功能下降,直至丧失生活自理能力。 除GV-971,目前为止,还没有针对神经元保护,用于减轻AD病理变化,延缓疾病病程进展的药物上市。基于减缓或降低Aβ沉积机理进行的AD药物研发项目达数百项。已有多个候选物进入III期临床试验,但均未能达到主要治疗指标,以失败或延迟告终。当前FDA仅批准六个AD治疗药物,均为症状改善药物。 GV-971由上海绿谷开发,为中国有条件批准的全球首个能够改善轻度到中度AD患者认知功能的药物。研究者通过前期研究,提出“菌群-肠-脑轴”在AD发生发展中分子细胞水平层面的致病理论,证明了GV-971靶向肠道菌群,通过“菌群-肠-脑轴”发挥作用。以下按“轴”线(图2,Ref.2),介绍研究过程与结果/发现。 (注:以下括号内斜体文字为该研究文章方法、结果、结论的引用、简述或归纳,作为支持证据以方便读者理解相关内容)。 (1)菌群组成紊乱:通过PCR分析肠道菌群,研究者发现转基因(Tg)AD模型小鼠随病理症状发展,肠道菌群 组成逐渐改变,在7个月龄时,厚壁菌门(Firmicutes)成为主要菌群。而且,AD小鼠与正常野生型(WT)小鼠同笼喂养7个月,能够导致WT小鼠菌群变化,趋向AD小鼠菌群组成。(因果发现:同笼喂养引起WT小鼠认知衰退)。 (2)菌群代谢产物异常:对7个月龄小鼠粪便进行代谢成分及通路富集分析,研究者发现氨基酸相关的代谢通路在AD与WT小鼠显著不同,表现为少数氨基酸,尤其是苯丙氨酸(phenylalanine,Phe),异亮氨 酸(isoleucine, Ile),在AD小鼠粪便中含量显著增高。(因果探索:a、这种增高,通过灌服WT小鼠粪便给AD小鼠,可以逆转。b、Phe和Ile在AD小鼠血液 及在轻度认知障碍(MCI)AD患者血液含量均显著高于正常对照。c、Phe及Ile体外促进小鼠脾免疫细胞CD4+T细胞更多分化为促炎性Th1细胞,腹腔注射,体内促进WT小鼠血液Th1增加) (1)致病蛋白沉积:AD小鼠随年龄增长,脑A β 沉积及过磷酸化Tau形成的神经纤维缠结增加,神经突触退化,呈现AD小鼠的典型病理变化。 (2)脑神经炎症:AD小鼠随年龄增长,活化的小胶质细胞(microglia)增加,对应亚型变化表现为促炎M1亚型增加,与之相反,具备神经保护的M2亚型反而下降。同时,AD小鼠外周免疫细胞脑侵润增加,表现为CD45high细胞比例显著增高,其中的CD4+T细胞促炎亚型Th1增加,非促炎亚型Th2降低。这些炎性细胞的增加,导致脑神经炎症(因 果探索:a、同笼饲喂 7 个 月,AD小鼠通过粪便可以诱导WT小鼠脑M1和Th1细胞增加。b、轻度认知障碍(MCI)AD患者血液中Th1显著高于正常人含量。c、7-9 个 月龄AD小鼠富集的肠道菌群与脑内免疫细胞比例呈正相关。d、研究推论:脑菌群失衡,导致Phe、 Ile异常增高,促使外周免疫细胞CD4+T细胞增加、分化为促炎性Th1亚型并 侵入脑,进一步诱发小胶质细胞促炎性M1型增加,从而促进Aβ沉积及Tau过度磷酸化形成神经纤维缠结) 。
图2“菌群-肠-脑轴” 在阿尔茨海默病( AD)进程中的病理变化及GV-971治疗机理
重塑肠道菌群平衡:GV-971在50、100mg/kg/day剂量下,可以重塑AD小鼠的肠道菌群平衡,使其趋向WT小鼠菌群组成。(相关佐证:将GV-971处理过的AD小鼠粪便灌服给其他未用药AD小鼠,使后者肠道菌群平衡趋向正常)。
纠正肠道代谢异常:口服GV-971,降低AD小鼠肠道粪便和血液中异常升高的Phe、Ile水平。
脑: 抑制炎症、组织病变及功能紊乱
i. 抑制神经炎症:表现为AD小鼠经过GV-971处理后,与WT小鼠对比,外周免疫细胞脑侵润减少,脑炎性免疫细胞Th1和小胶质细胞M1数量减少/活性降低,伴有脑内多种细胞因子水平广泛下降。(因果关联:GV-971给药后,AD小鼠脑内免疫细胞与与肠道菌群关联性显著减少)。 ii. 抑制 A β 斑块沉积及Tau蛋白形成神经纤维缠结 (2)中国III临床 期试验结果:GV-971于2014年在中国进入III期临床试验,试验于2018年完成。818名轻至中度阿尔茨海默病(AD)患者入组。试验组口服450mg GV-971,每日2次,试验时长36周。GV-971给药1月时即统计显著性地改善了患者认知功能(ADAS-Cog12评分 ,主要疗效指标),并在36周结束时,改善作用范围更加扩大。亚组分析表明,GV-971的疗效与AD严重程度成正相关关系。终点数据分析表明,GV-971疗效及安全性均达到临床预期结果。此外,研究者在会议报告中展示的患者脑片显示GV-971减少了患者脑A β 沉积。 综上动物研究结果,AD发展中的因果循环为:脑A β 和Tau沉积/缠结-肠道菌群组成与代谢紊乱-外周及脑炎症-认知功能障碍。口服GV-971治疗机理:回调紊乱肠道菌群与代谢-抑制外周及神经炎症-减少A β 和Tau沉积/缠结-改善认知障碍,达到治疗AD目的。
由于血脑屏障(BBB)及疾病发病和治疗机理复杂性及不清晰性,直接靶向中枢神经系统的药物开发难以成功。GV-9 71通过“远程”靶向肠道菌群,从而间接达到治疗中枢神经系统疾病,治疗机理/策略具有显著优势和普适性。 研究发现,不仅AD,其它神经系统疾病,如自闭症 抑郁症 帕金森症 PD 肌萎缩侧索硬化 ALS 疾病治疗目的。 那么,通过一种药物,如GV-971, 有可能治疗多个复杂(涉及多系统、多靶点,或靶点不清等)的神经系统疾病。 胃肠道菌群与代谢性疾病(肥胖、糖尿病、非酒精性脂肪肝等)、脑血管疾病、肿瘤等亦有着密切的关系。套用/学习“肠-脑轴”思路,以肠道为起点,有许多研究者聚焦“肠-肝轴”、 “肠-肺轴”等“肠-X轴”,进行药物开发研究, 如有研究证明口服干酪乳杆菌代田株(Lactobacillus casei strain Shirota,LcS)可以抑制大鼠非酒精性脂肪肝炎发展。(相类似,已有多种益生菌、益生元等营养保健品,作为食品广泛应用)。另外,通过基因工程技术改变或利用肠道菌群,在肠道生成特定产物或药物,达到治疗“肠-X轴”X端的疾病,如炎症性肠炎、2型糖尿病等,也正受到学术界及药企高度重视和投入。 (1)疾病因果关系在“肠-脑轴”中的复杂性与药物靶向策略 如上介绍,肠道菌群紊乱 可以由内部因素如代谢病类的糖尿病及基因突变引发的神经功能紊乱导致,也可以因外部因素如不健康饮食、药物、病菌等引起。就关联的中枢神经系统疾病而言,肠道菌群紊乱可以是发病过程中的结果,也可以是发病诱因。因而,针对“肠-脑轴”治疗 的药物靶向点/位,应该根据疾病及节点重要性及可干预性做出最优选择和设计。但这正是巨大挑战。 实际上,早期研究中,GV-971作为从海藻提取的海洋寡糖(alginate oligosaccharide, AOS),在体外试验中被发现能与A β 结合,抑制A β 聚集形成纤维,亦对形成的A β 纤维去稳态(destabilize),转化其为无毒性的单体,还可以促进小胶质细胞(microglia)介导的A β 内吞噬(phagocytosis)。人体PK试验也证明GV-971能够通过BBB进入大脑。因此,除靶向肠道菌群,GV-971被认为也直接靶向A β 生成与降解。这些展示了GV-971的多靶向功能, 同时也可能意味单靶向肠道菌群疗效或许不足。更具挑战的是,由于“肠-脑轴”治疗机理由动物试验结果推出,且使用的是基因突变AD模型鼠,因而,GV-971在人体内的作用机理是否相同,及对A β 作用的疗效权重如何,期待更多研究发现解疑。 靶向“肠-脑轴”的肠道菌群进行疾病 治疗是可行有效的。然 而,因个人饮食生活习惯、基因背景、人种及地域等差异,肠道菌群组成、疾病状态下的紊乱及对药物的应答,极大概率会出现显著的个体差异;此外,肠道菌群紊乱,可以是导致机体功能和器质性病变的原因,也可能相反。因此,如何开发或使用基于“肠-脑轴”作用机理药物,实施精准个性化治疗,是药物开发者要面临、解决的难题。期待后续GV-971人体中作用机理的研究及在海外开展的III期临床试验的发现和成果,为更多的基于“肠-X轴”的药物开发奠定更扎实的基础。
针对“菌群-肠-脑轴”进行药物开发,已有成功案例(GV-971)。未来更多的基于该原理进行的靶向“肠-X轴”的药物开发,可以形象比喻为“盲人摸象”式研究,寻找(开发)“隔山打牛”的工具(药物)和技术。其中,对“山”的认知、可控,精准区分“牛、羊”等,至关重要。
参考文献:
(1)Front. Aging Neurosci. 9:106.doi: 10.3389/fnagi.2017.00106
(2)Cell Research (2019) 0:1–17.https://doi.org/10.1038/s41422-019-0216-x
– END –
本文为投稿作品,欢迎朋友们投稿,详情请见:
大风起兮药飞扬,同药盼兮好文章!
发布者:药时代,转载请首先联系contact@drugtimes.cn获得授权




 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
