现代西方医学认为癌症来源于正常组织细胞的基因突变,这些基因突变赋予了癌细胞增殖分化异常、生长失控、浸润性及转移性等特征。癌症的传统治疗方式是手术、放疗和化疗,后来出现了靶向疗法和新兴的免疫治疗,虽然靶向和免疫疗法给癌症病人带来了曙光,也取得了一定疗效,但是目前这些药物和疗法在克服癌症耐药和治疗癌症病人有效率上还有待进一步提高。
当前癌症治疗的难题主要是转移和复发,能控制转移和复发癌症就能成为慢性病。癌症转移复发的最主要原因是癌细胞逃避了免疫系统的监视以及癌细胞对免疫系统的抑制。
长久以来人们试图揭示癌细胞逃避免疫监视和抑制免疫系统的途径和方法,以期望在癌症治疗中实现重大突破,近几年来随着科学研究的深入,癌细胞的众多逃逸机制得以发现和阐明,这些都可能成为癌症复发转移的直接或间接原因,阐明这些机理和相关联系对于我们开发癌症治疗药物和指导癌症治疗具有重要的意义。
截至最新研究发现影响癌症复发转移因素主要有以下几个方面:
(1)癌细胞自身变化和调节作用使癌细胞逃避免疫系统的监视而复发和转移;
(2)癌细胞释放外泌体或分泌蛋白促进癌症复发和转移;
(3)T细胞功能异常导致抗癌免疫降低而促进癌症复发转移;
(4)抗原提呈及加工处理缺陷导致依赖于T细胞的抗癌免疫不能发挥作用促使癌症复发和转移;
(5)肿瘤微环境中的抑制细胞和相关分子对抗癌免疫的抑制作用;(6)血液内环境促进癌症转移;
(7)压力促进了癌症的发生发展和复发转移;
(8)肠道微生物调节并影响了抗癌免疫;
(9)人们日常饮食对于癌症复发和转移的影响。
本文我们首先将围绕这几个方面的代表性研究成果作一综述和分析,期望大家从不从层面对癌症复发转移的因素有一个全面及客观的了解和认识,各取所需。
文章的第二部分阐述了由癌症复发转移的影响因素而引发的对于癌症药物开发和如何选择治疗策略的一些思考。
一、癌细胞自身的变化和调节作用使其逃避免疫系统的监视
癌细胞常常善于伪装自己,他可以通过改变自身细胞内或细胞表面相关蛋白的表达而逃避免疫系统的监视和攻击。
让我们看看癌细胞的这些伪装伎俩:
(1)癌细胞通过减少自身表面的HLA-I类分子的表达或缺失相关分子来逃避T细胞的杀伤。人们发现低表达HLA-I类分子的癌细胞其mRNA水平降低,某些时候即使给这些癌细胞提供MHC-I类基因也不能使其有效表达HLA-I类分子,这可能是由于HLA-I类分子的组装及转运异常所致,因为HLA-I类分子的稳定表达需要在内质网内首先组装成重链、轻链和肽分子的三分子复合物,再转运至细胞表面,这一过程需要TAP、LMP基因协同作用,癌细胞中蛋白酶体酶(LMP)或TAPI/TAP2异常会导致I类分子表达异常。
(2)癌细胞(例如肝癌、肺癌、乳腺癌、胃肠道肿瘤等)高表达fas-L蛋白通过fasL-fas途径逃避免疫系统杀伤:在机体抗癌免疫应答过程中,活化的肿瘤特异性T细胞fas蛋白表达增高,因此瘤细胞可通过fasL-fas途径介导肿瘤特异性T细胞凋亡,另一方面,肿瘤细胞内某些Fas信号传导分子可发生获得性缺陷,从而抵制FasL介导的细胞凋亡,并逃逸免疫攻击。
(3)癌细胞通过上调β-catenin的表达,进而抑制CCL4分子导致机体无法招募CD103+树突状细胞,最终导致T细胞无法渗透进肿瘤组织并在肿瘤组织聚集,从而使抗癌免疫减弱[1]。
除了以上这些变化外,癌细胞还常常利用唾液粘多糖或封闭因子隐藏相关抗原而逃避免疫系统的攻击。癌细胞的这些蛋白表达的变化可以通过基因组层面、RNA水平以及表观遗传学的改变而发生。
抑癌信号通路也是癌细胞作用的对象。
例如TGF-β信号通路对癌症形成具有不可或缺的功能,TGF-β信号分子在癌症发生的不同阶段具有不同的作用,其作用具有两面性。研究发现TGF-β在癌症发生的早期具有重要的抑癌作用,癌细胞正利用这一点在早期就建立起逃逸这一信号的分子机制,癌细胞正是通过策反TGF-β信号通路中的一个关键成员SMAD4来达到自己的目的。
研究发现在胰腺癌和消化道肿瘤中SMAD4会发生高频率的缺失和突变,而在淋巴瘤、肺癌、神经母细胞瘤中存在其它导致TGF-β信号失活的调控机制,这些癌细胞中的ALK分子异常激活。最近研究发现ALK阳性肿瘤细胞中,激活型ALK直接结合SMAD4并对其第95位酪氨酸进行磷酸化修饰进而导致SMAD4丧失了与DNA结合的能力,进而不能正常传递TGF-β信号和调控下游基因的表达,导致TGF-β的肿瘤抑制功能丧失[2]。
休眠癌细胞是导致癌症复发转移的一个重要因素。研究发现从原位转移的癌细胞可以通过非折叠蛋白反应的模式,改变癌细胞表面特征性分子的表达,使癌细胞处于休眠状态而不容易被人体免疫系统发现并清除,而在特定的环境下,例如炎症引发的嗜中性粒细胞增加,引起细胞释放嗜中性粒细胞胞外陷阱,从而促进了休眠癌细胞的复苏[3],此外癌细胞还通过CK2α的过表达接管了机体的生物钟机制并将其用于帮助癌细胞生长[4]。
癌症抗原诱导人体自身免疫耐受而逃避免疫系统的攻击。癌细胞在宿主体内长期存在和不断增长的过程中,其抗原可作用于处在不同分化阶段的特异性淋巴细胞,其中处于幼稚阶段的淋巴细胞接触癌症抗原后即可被诱发免疫耐受。
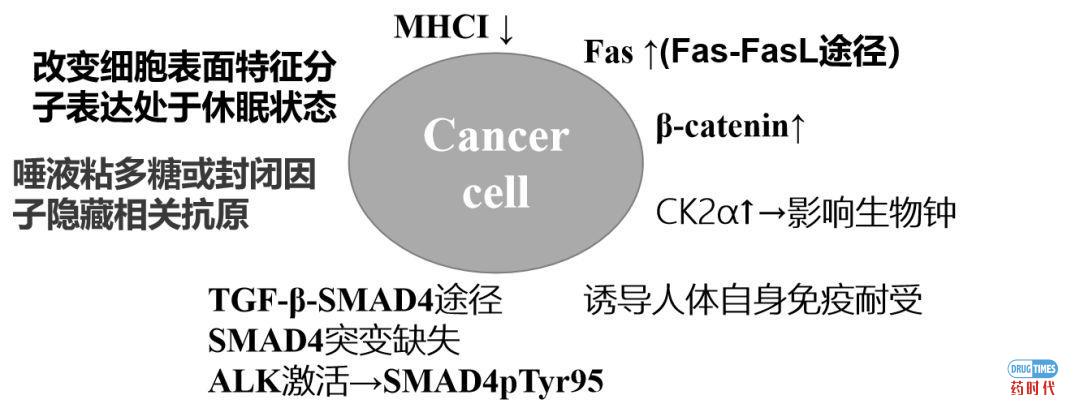
癌细胞自身变化和调节作用逃避免疫系统监视
二、癌细胞释放为囊泡或分泌蛋白促进癌症复发转移
癌症原发部位好比癌细胞的大本营,癌细胞将miRNAs包裹进微囊泡尤其是外泌体中,微囊泡充当了传递miRNAs的运输机,在特定条件下可有效地将miRNAs传送到特定组织的受体细胞处,在那里miRNAs阻断靶基因的翻译,调控受体细胞功能从而使癌症发生转移。此外相关研究还发现快速生长的癌细胞可高水平表达某些致癌miRNAs,大量生成和释放包含这些miRNA的微囊泡,调控免疫细胞的抗肿瘤活性。
下面我们来看看癌细胞通过外泌体转移的最新研究发现:(1)最近研究报道在各种类型的人类癌症和小鼠肿瘤模型中miR-214分泌增加,癌细胞借助微囊泡miR-214运输到受体T细胞处。在靶向小鼠外周血CD4+T细胞中,癌细胞分泌的miR-214能有效地下调PTEN表达并促进Treg扩增导致免疫抑制和肿瘤生长,此外miR-214还能诱导的Tregs分泌较高水平的IL-10,促进了裸鼠体内的肿瘤生长[5]。(2)在乳腺癌的研究中人们发现将人类乳腺癌外泌体与正常细胞混合注入到小鼠体内后可以引发肿瘤[6]。(3)紫杉醇是化疗中常用的一种药物,然而紫杉醇会促进小鼠乳腺癌往肺部转移,令人们惊讶的是受过化疗的癌细胞分泌的外泌体中多了一种叫做annexin-A6(膜联蛋白A6)的蛋白质。在化疗之后,肿瘤外泌体里的annexin-A6水平显著升高,含有annexin-A6的外泌体随血液循环到达肺部后会促进肺细胞释放趋化因子2(CCL2),CCL2会吸引能促进癌细胞在肺部存活及生长的单核免疫细胞。由此可见乳腺癌化疗以后癌细胞分泌的外泌体给肿瘤转移创造了良好的环境[7]。
癌细胞除了通过外泌体传递miRNA和蛋白发生转移外,癌细胞还可以分泌一些蛋白来改变周围正常细胞使其恶化或通过影响免疫细胞而逃避免疫系统的攻击。我们看看最近报道的两个例子:(1)前列腺癌细胞分泌的EN-2蛋白被其他细胞吸收后,会加速这些正常细胞肿瘤化,此外正常细胞吸收的EN-2会调节MX2基因的表达使得正常细胞具备抗病毒的能力,此时免疫系统就会放松对这些细胞的监控,这也会让蛰伏于正常细胞附近的癌细胞逃过免疫系统的追捕。由此可见改造病毒的癌症免疫治疗方法可能会因为EN-2蛋白的这种功能而降低效率[8]。(2)癌细胞可以分泌一些蛋白来对抗杀伤性T细胞、NK细胞或治疗药物:癌细胞会分泌PD-L1片段,诱捕PD-L1抗体,阻断T细胞再激活[9];癌细胞可以提高金属蛋白酶和ERp5的表达进而产生高水平的可溶性的MIC-A来破坏NK细胞介导的肿瘤杀伤效应;癌细胞可以分泌IL-10、TGF-β抑制性细胞因子抑制NK细胞和T细胞的活性;癌细胞能够分泌CD20,导致对利妥昔单抗的抗性[10],癌细胞还会分泌Notch诱饵蛋白阻断抗血管生成的治疗[11]。

sPD-L1剪接变体模型与抗αPD-L1抗体治疗[9]
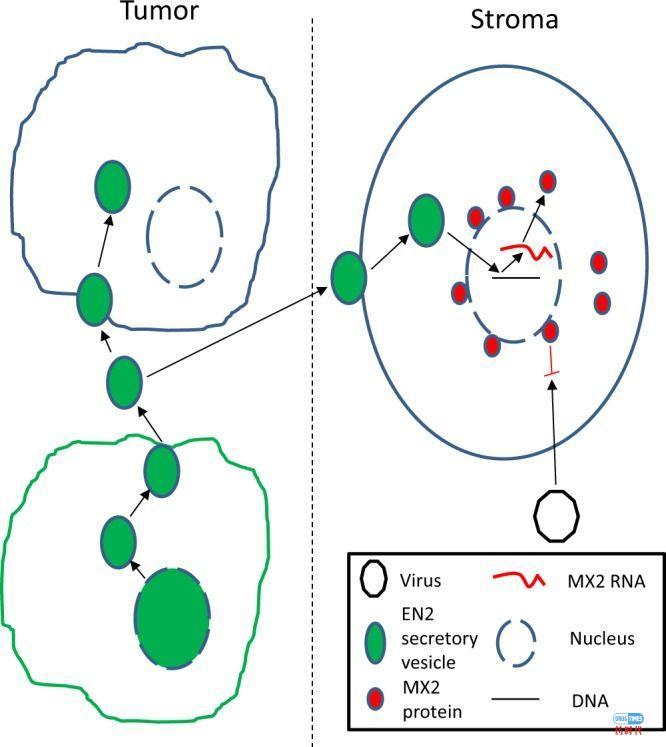
EN2分泌可介导基质中的抗病毒变化。在表达癌细胞的EN2(绿色)中,EN2蛋白存在于细胞核和细胞膜中以及微泡内,这些微泡可以被基质中的其他癌细胞和非癌细胞分泌和摄取。在非癌细胞中,EN2激活MX2(红色)的转录,MX2是针对病毒感染的先天防御的关键组分[8]
三、T细胞功能异常导致抗癌免疫降低或丧失
肿瘤细胞表面的黏附分子及共刺激分子的表达常常缺失,使得T细胞活化过程中缺乏第二信号而不能被有效激活,此外某些负向调控的共刺激分子高表达显著抑制了T细胞的激活。如肿瘤细胞通过表达细胞毒T淋巴细胞相关抗原,程序性死亡配体1、Fas配体等,可以与T细胞或自然杀伤性细胞直接接触,下调其杀伤能力并介导其凋亡,使肿瘤微环境中的细胞毒性效应T细胞处于耗竭状态,抑制抗肿瘤的免疫应答。
四、抗原提呈及加工处理缺陷导致依赖于T细胞的抗癌免疫不能发挥作用
癌细胞生长过程中会分泌不同的细胞因子(包括神经节苷脂、神经肽、NO和其他分子等),这些细胞因子可干扰DC细胞正常分化的进程,导致DC细胞不能够正常成熟,甚至诱导其凋亡,最终使得DC细胞功能缺陷和数量减少。Gigante等研究发现存在于肿瘤浸润部分的DC易于凋亡且抗原递呈能力大幅降低,相关研究还发现高分化的实体肿瘤中存在较多的肿瘤浸润性DC,提示肿瘤浸润性DC的密度与肿瘤病理分级和分期呈负相关,与预后呈正相关。大多数肿瘤患者存在DC功能障碍和数量减少。
五、肿瘤微环境中的抑制细胞、相关分子及代谢产物对抗癌免疫的抑制作用
肿瘤微环境由不同的细胞和非细胞成分组成。细胞成分包括癌相关成纤维细胞(CAF),内皮细胞,免疫细胞(T细胞,肿瘤相关巨噬细胞(TAM),树突细胞,肥大细胞等)和癌症干细胞(CSC)。分泌的非细胞成分包括细胞因子,生长因子,代谢物和细胞外基质(ECM)蛋白。这些细胞和非细胞组分在肿瘤生长、耐药及转移中都起着重要作用。
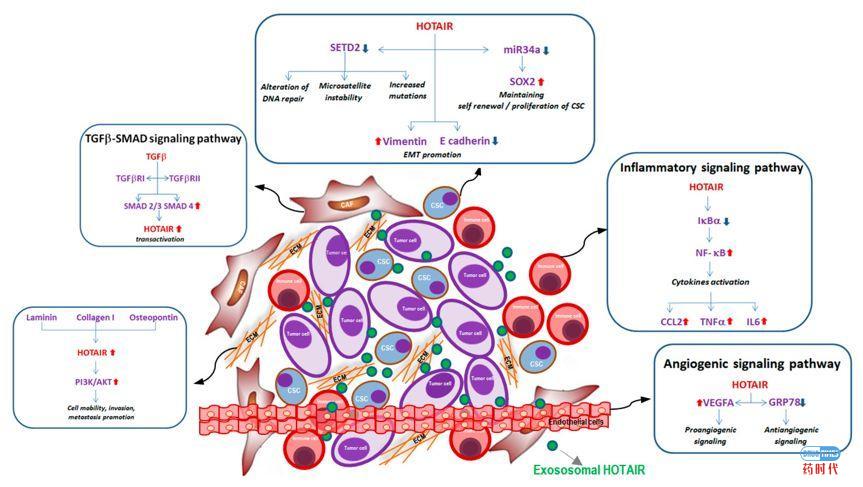
肿瘤微环境中的细胞、LincRNA-HOTAIR及影响的相关信号通路
1、骨髓来源的抑制性细胞
骨髓来源的抑制性细胞(MDSC)能够通过多种途径抑制免疫系统,负向调控肿瘤免疫功能。对于天然免疫系统,MDSC可以直接抑制相关免疫细胞,阻断NK细胞分泌IFN,MDSC可以通过下调NK细胞表面的NKG2D受体分子来发挥发挥免疫抑制功能。对于获得性免疫系统,MDSC可以抑制CD4+T细胞和CD8+T细胞增殖和归巢,通过诱导型一氧化氮合酶、活性氧、吲哚胺2,3-双加氧酶等多种细胞因子直接抑制淋巴细胞的增殖和分化,又可以诱导调节性T细胞(Treg) 发挥间接抑制机体免疫应答反应的作用[12]。
2、肿瘤相关成纤维细胞
肿瘤相关成纤维细胞(CAF)是肿瘤微环境的重要组成部分,在癌细胞的代谢、生长、转移、免疫逃逸和化疗耐药等方面都具有重要作用。CAF的代谢重编程是其促进癌症生长转移耐药的主要因素。CAF可以分泌大量的细胞因子、趋化因子和促血管生成因子直接或间接调节肿瘤免疫;通过调节肿瘤间质液压酸化肿瘤微环境,分泌可溶性因子促进肿瘤耐药;此外CAF可募集抑制性免疫细胞,在肿瘤局部形成抑制性免疫微环境,促进上皮-间质转化,激活癌细胞增殖的信号通路从而促进其生长、耐药。最新研究表明特定类型的CAF(CD10+ GPR77+)还能为癌症干细胞(CSCs)提供存活生态,来促进肿瘤形成和化疗耐药性,此外在头颈癌中CAF还可以增强miR-196a的表达最终促进癌细胞对于化疗药物顺铂的耐受。
3、肿瘤相关巨噬细胞
肿瘤相关巨噬细胞(TAM)在肿瘤的生长、血管形成、侵袭及转移等方面具有促进作用;肿瘤组织的免疫抑制性微环境会影响TAM的表型和功能。肿瘤相关的巨噬细胞通过细胞外小泡传递一种髓系特异性的IncRNA,HIF-1α稳定的长非编RNA(HISLA)增强乳腺癌细胞的有氧糖酵解和凋亡抗性。在机械作用下,HISLA阻断PHD2与HIF-1α的相互作用,抑制HIF-1α的羟基化和降解。反过来,糖酵解性肿瘤细胞释放的乳酸能提高巨噬细胞中的HISLA,构成TAMS与肿瘤细胞之间的前馈循环。阻断细胞外小泡介导的HISLA在体内抑制乳腺癌的糖酵解和化疗耐药。临床上,HISLA在TAMS中的表达与乳腺癌患者的糖酵解、化疗疗效差和生存期短有关。通过多种途径对巨噬细胞的功能和表型进行干预和改造,可增强巨噬细胞在肿瘤微环境中的识别、吞噬和抗原提呈能力,促进巨噬细胞对肿瘤的杀伤。
4、调节性T细胞
调节性T细胞是发挥负性免疫调节功能的一类CD4+T细胞,是肿瘤免疫微环境的重要组成部分,在肿瘤微环境中能够抑制癌症免疫反应,协助癌细胞免疫逃逸。在肿瘤微环境中癌细胞可以有效地招募Tregs来逃避宿主免疫反应,目前已知多种细胞因子如IL-2和TGF-β可以导致Tregs扩增,最新研究发现肿瘤细胞分泌的外泌体中的某些microRNA同样可以促进调节性T细胞的扩增,促进癌症的复发转移。最近复旦大学的研究团队发现引流淋巴结里面的癌细胞诱导了调节性T细胞的产生,调节性T细胞通过下调杀伤性T细胞S1P1受体的表达,将杀伤性T细胞限制于肿瘤引流淋巴结里不能发挥肿瘤杀伤作用,如果消除肿瘤引流淋巴结里面的调节性T细胞就能使杀伤性T细胞的抗肿瘤活性得以恢复,如果能开发出消除局部调节性T细胞的疗法或药物将具有巨大的价值
5、调节性B细胞
调节性B细胞是一类具有免疫调节功能的B细胞亚群,调节性B细胞分泌细胞因子及抗体,或与其它细胞相互作用发挥其免疫调节功能。调节性B细胞分泌的主要细胞因子是IL-10和TGF-β。TGF-β在癌症免疫微环境中可以抑制大多数免疫细胞的增殖分化,诱导效应B、T细胞的凋亡。调节性B细胞还可以通过CD40/CD40L、CD80、CD86等协同刺激分子及Fas配体,诱导效应性T细胞的凋亡和Treg的募集活化。
6、内皮细胞
肿瘤微环境中的内皮细胞负责支持肿瘤新血管系统,也参与几种分子信号传导途径。事实上,肿瘤相关的内皮细胞显示出高TGF-β1和CD105表达,参与促进肿瘤血管生成。
7、癌症干细胞
癌症干细胞(CSCs)是肿瘤微环境的重要组成部分,在促进癌症侵袭转移及癌症耐药性方面具有重要的作用。CSC的增殖受到来自肿瘤微环境细胞的许多外在因素的调节,目前几项研究表明,不同的lncRNA能够调节促进肿瘤进展的CSCs增殖。
8、癌症发生或转移部位的正常细胞充当癌细胞保护伞
癌细胞常常与组织中的正常细胞相互交互,促进癌症的进展。最近在胰腺癌的研究中发现,胰腺星型细胞在胰腺癌发生发展过程中起了关键的作用,在正常胰腺组织中,胰腺星型细胞处于休眠状态,当癌症发生的时候,胰腺星型细胞被激活分泌LIF蛋白向肿瘤细胞传递刺激信号,从而加速胰腺癌的进展。此外在对癌细胞转移的研究中发现,最初转移的癌细胞进入目标肺组织后,发生了坏死和崩解,癌细胞崩解释放出大量细胞颗粒通过血液扩散进肺部深层组织。这些细胞碎片不断地被免疫细胞吞噬,这些吞噬了癌细胞颗粒的免疫细胞在局部组织中潜伏下来,给后来的癌症细胞提供安全的庇护所,从而为癌症细胞建立转移灶开辟道路[14]。
9、肿瘤微环境中存在的多种蛋白酶、细胞因子、不同类型的RNA
肿瘤微环境中的蛋白酶和细胞因子是由肿瘤微环境中的不同细胞分泌,对于促进癌症的发生发展及转移具有重要的作用。例如肿瘤相关成纤维细胞表达的成纤维细胞激活蛋白-α能够改变胶原蛋白结构和降解纤连蛋白而促进微环境基质的重建,进而增强肿瘤细胞侵袭能力;同时成纤维细胞激活蛋白-α和一些细胞因子协同作用阻止免疫细胞聚集,抑制肿瘤组织内浸润免疫细胞的功能从而促进肿瘤的生长。肿瘤微环境中主要的抑制性细胞因子是IL-10和TGF-β,IL-10能介导APC功能抑制,最终抑制T细胞的功能;TGF-β诱导肿瘤相关巨噬细胞和TAN极化,阻断树突状细胞的成熟,促进调节性T细胞的产生,还可以募集髓系抑制性细胞,加强TGF-β信号在肿瘤微环境中的促癌作用。肿瘤微环境中的某些细胞因子在疾病发生的不同阶段具有不同的作用,例如IFN-γ在疾病初期通过诱导CXCR3促进细胞毒性T细胞和NK细胞的补充。然而,在疾病发展过程中,IFN-γ促进被认为是限制组织受损的负调节机制。例如抑制中性粒细胞的补充,上调抑制受体PD-L1,以及T细胞抑制代谢酶,如IDO和INOS。肿瘤微环境中还有不同的RNA分子,对于癌症的进展和转移也都具有重要的作用。
10、肿瘤微环境中的相关代谢分子组成的代谢微环境及其他环境因素的影响
代谢发生改变是肿瘤细胞的重要特征之一,代谢改变与肿瘤的发生发展互为因果关系。肿瘤代谢具有6大特征:1、葡萄糖与氨基酸摄取的失控2、营养获取途径的投机性3、利用糖酵解/三羧酸循环的中间产物合成生物大分子与NADPH4、氮源需求增加5、代谢物驱动的基因表达失控5、代谢物与微环境相互作用[15]。下边我们来看几个和癌症代谢相关的重磅研究发现。下图展示了肿瘤、肿瘤微环境和其他环境因素之间的相互作用。
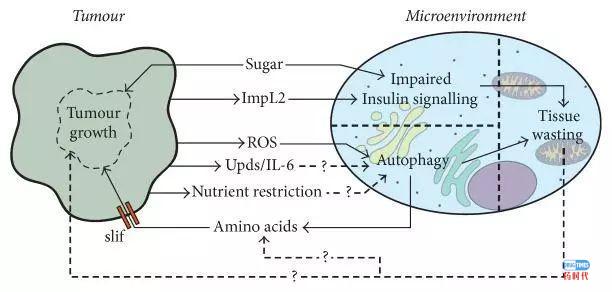
肿瘤与其微环境(TME)之间的代谢相互作用。肿瘤,TME和其他环境因素之间的相互作用在此图中表示。实线箭头表示已证实的相互作用,而带有问号的虚线表示假定的相互作用。
图片来源:BioMedResearch International2018
1、癌细胞具有代谢偏好性:NAD在细胞氧化还原反应中起传递电子的关键作用,是细胞能量代谢所必需的,已知在哺乳动物细胞中一共有三种合成NAD的代谢通路,在NAD代谢通路中NAPRT酶是合成NAD的关键,研究发现在某一类型的组织中NAPRT酶高表达,这些组织的癌细胞就会依赖于这一途径合成NAD,例如前列腺癌、卵巢癌、胰腺癌、胃肠道癌就充分利用了NAPRT酶生成NAD,因此我们可以开发NAPRT的抑制剂来治疗癌症。
2、乳腺癌研究中发现糖酵解过程中的关键激酶-果糖激酶PFKFB4可以磷酸化转录激活蛋白SRC-3蛋白857号位的丝氨酸,增加其转录活性,进而成为乳腺癌细胞增殖和转移的帮凶。此外糖酵解过程中产生的1,6-二磷酸果糖还能够促进RAS基因的超活化。
3、最近研究发现肿瘤微环境中不断堆积的K+会严重影响T细胞的代谢,触发T细胞营养摄取限制和功能性限制,导致T细胞不能从外界环境中摄取营养,等同于切断T细胞的动力输送通道。由此T细胞便丧失了对癌细胞的杀伤能力而且容易发生自噬,自噬的T细胞将胞内的K+释放进一步增加了肿瘤微环境中K+浓度,从而形成恶性循环[16]。
癌细胞生长迅速,在快速增殖的过程中需要同时平衡分解代谢和合成代谢需求,癌细胞在糖代谢、氨基酸代谢、脂代谢、核苷酸代谢等方面均发生了代谢重编程。在癌细胞代谢重编程的过程中,许多和代谢相关的酶发生了突变导致了癌症的进展和转移,这些变化影响了癌症代谢微环境的变化,代谢微环境的变化反过来又促进了和代谢相关的信号通路及相关基因的改变。目前已有的抗代谢药物只能有效对抗某些癌症类型,肿瘤中存在代谢异质性,在肿瘤中广泛存在的靶点在不同癌症中的作用还不尽相同,此外癌细胞还存在其它代谢补偿途径,癌症代谢和免疫代谢之间存在着密切的联系,某些抑制癌症代谢的策略仍存在不可预见的副作用。
尽管存在诸多困难,但是针对代谢重编程的癌症治疗仍具有巨大的潜力,未来我们需要研究正常细胞、免疫细胞及癌细胞的代谢差异和联系,找到其中一些关键调节因素,针对代谢微环境和癌细胞代谢偏好性进行联合治疗。
上面我们从10个方面分析了肿瘤微环境的影响因素,肿瘤微环境中不仅存在不同类型的细胞、还存在由这些细胞分泌的蛋白酶和细胞因子,以及肿瘤微环境中的相关代谢分子以及支持组织,上述诸多方面共同构成了一个复杂多样的肿瘤微环境。最近病理学家Bendall利用多路粒子束成像技术(MIBI)绘制了肿瘤微环境不同细胞的细致图谱,这对于肿瘤治疗意义重大[17]。此外目前还发展了许多技术方法,例如飞行时间质谱流式细胞术,基于单细胞的转录组测序,但是目前各种方法都有其局限性,因此未来不同方法的配合,有可能产生更好的效果。
六、血液环境对于肿瘤的影响
循环系统是分布于全身各部的连续封闭管道系统,它包括心血管系统和淋巴系统。因为淋巴液是沿着一系列的淋巴管汇入静脉,因此淋巴系统也可认为是静脉系统的辅助部分。心血管系统内循环流动的是血液,因为氧气和营养物质都需要靠血液运输到全身各个重要组织和器官,不同组织和器官代谢的废物也需要靠血液运输到肺部和肾脏排泄掉,因此循环系统的正常功能和稳定的血液内环境对于生物体的健康十分重要。同样,血液内环境对于癌细胞的生长,对于癌症的发展转移具有重要的作用,下边我们来看一个例子。
Madak-Erdogan研究组比较了健康女性的血液与研究开始时健康但后来发展为乳腺癌的女性的血液,研究发现患乳腺癌的女性,以及超重或肥胖的女性血液中游离脂肪酸和甘油的浓度明显较高,当脂肪组织分解甘油三酯时,这些游离脂肪酸和甘油会作为副产物释放出来。用肥胖妇女的血液处理几种原发性肿瘤和转移性癌细胞后发现,随着血液样本中脂肪酸含量增加,癌细胞变得更具有生存能力和增殖效应。暴露在妇女血液样本中所含脂肪酸下的癌细胞更具侵袭性,研究中发现一种原发性肿瘤细胞活力增强,调节细胞生长、增殖和存活的酶途径被激活,而且这种效应和脂肪酸水平呈正相关[18]。
七、人体内的微生物调节
人体肠道中生活着数以万亿计的微生物,这些微生物共同产生数千种小分子和代谢物,这些小分子和代谢物同人体肠道细胞及免疫细胞相互通讯,相互作用,进而影响人体生理的多个方面。研究发现人体肠道菌群失调可能导致多种疾病,其中癌症的发生发展转移和肠道微生物有密切的联系。人体肠道菌群和肠道免疫细胞之间的信号通讯,维持了肠道内稳态的平衡。最新研究发现人类肠道微生物多样性降低与结肠癌密切相关,例如结肠癌患者肠道内的梭状芽胞杆菌种类减少,这种细菌能够间接预防结肠癌变和炎症反应,同消化道炎症密切相关的梭菌属和卟啉单胞菌属细菌的增加有可能触发癌变。最近研发发现癌细胞会影响脂肪细胞,促使其过量产生一种叫做IGFBP1的蛋白质。这种蛋白质会让健康细胞对胰岛素不敏感,变相增加了血糖水平,但是由于癌症患者肠道菌群中缺乏能够调节血糖的一类拟杆菌,因此不能很好的调节血液中血糖的增加,促进癌症进展[19]。
目前研究肠道微生物和疾病关系的方法有两种,第一种方法是从免疫表型开始,逐步缩小微生物群以识别发挥作用的效应细菌,而第二种方法是从细菌衍生的分子和代谢物开始,试图了解它们对宿主免疫系统的影响。使用这些策略,研究人员可以通过分析宏基因组数据来发现与特定疾病相关的生物合成信号通路,并且据此发现多种拥有这一生物合成信号通路的微生物[20]。
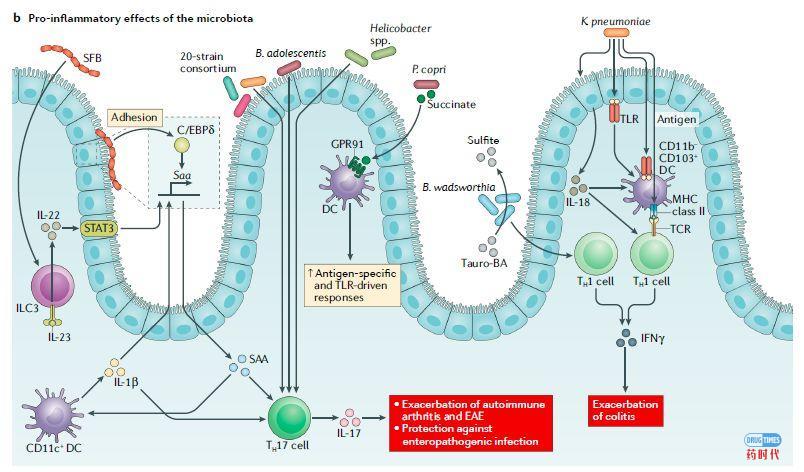
肠道微生物的促炎作用NatureReviews Immunology2019
对于肠道微生物和肿瘤发生发展和治疗的关系,我们应该积累更多的病例数据,研究不同的肠道微生物的数量、种类和丰度同癌症发生、发展和转移的联系,找到相互之间的联系,深入研究在癌症治疗以后有反应的患者的微生物种类及数量,以及这些患者在治疗前和治疗不同阶段微生物种类和数量的动态变化,揭示其中的规律,从而为更好的开发微生物疗法和同别的疗法配合使用奠定坚实的理论基础。
八、压力和癌症进展以及复发转移的联系
我们每一个人都经受过压力,目前已经有大量研究证明慢性压力对癌症进展有影响。慢性压力诱导了来自交感神经系统(SNS)的信号传导并驱动了癌症进展。慢性压力重建肿瘤内和周围的淋巴网络,为肿瘤细胞逃逸提供途径。研究显示源自肿瘤细胞的VEGFC是应激诱导淋巴重塑所必需的,与巨噬细胞炎症信号传导中的关键分子COX2密切相关。抑制交感神经系统信号传导阻断了慢性应激对体内淋巴重塑的影响,并减少了临床前癌症模型和乳腺癌患者的淋巴转移,这些发现揭示了应激诱导的神经信号传导和炎症之间的意外交流,慢性压力调节了肿瘤淋巴结构并促进癌症的淋巴结转移,这些发现表明通过限制交感神经信号,可以限制癌症通过淋巴系统转移并改善癌症的治疗效果[21]。
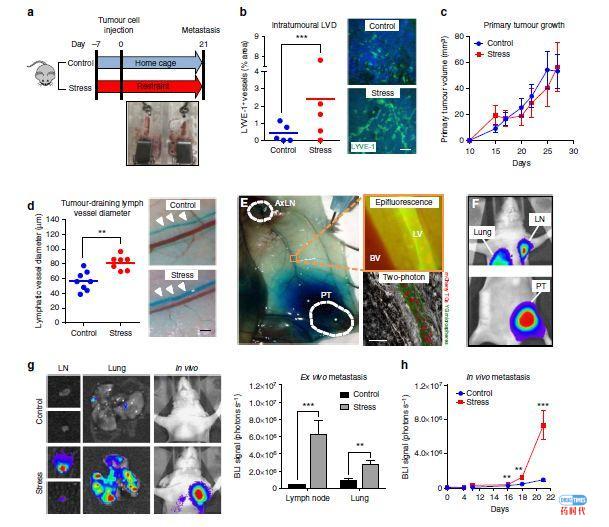
慢性应激重塑肿瘤相关淋巴结构促进淋巴结转移[21]
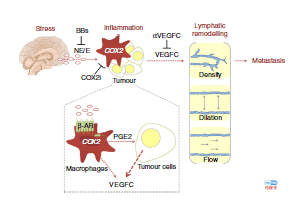
压力诱导的肿瘤淋巴重塑[21]
此外研究还发现,压力导致了AMPK在S256磷酸化Skp2并促进Skp2SCF复合物的完整性和E3连接酶活性,导致K63连接泛素化和Akt活化,进而导致了癌症发生。重为要的是,AMPK介导的Skp2S256磷酸化促进小鼠肿瘤模型中的乳腺癌进展,并与乳腺癌患者中的Akt和AMPK活化相关[22]。
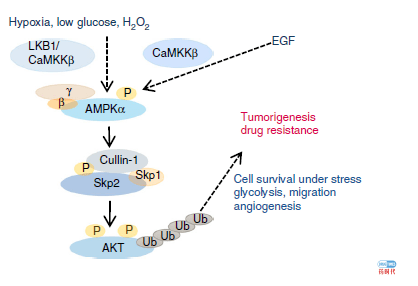
压力通过AMPK介导的癌症相关信号通路的激活[22]
最近,青春期后期的抗压力与癌症患者的生存率有关。低的抗压能力导致了癌症患者死亡率的增加。抗压能力的个体差异可能会影响某些类型男性癌症患者的生存。有研究表明,男性癌症患者(特别是口咽癌,上呼吸道癌,前列腺癌和霍奇金淋巴瘤)抗压力和死亡率之间存在显著关系。
迄今为止,压力易感性对癌症进展的潜在影响仍然未知。在卵巢癌小鼠模型中的研究发现慢性应激通过β2肾上腺素能受体激活肿瘤细胞环AMP(cAMP)-蛋白激酶A(PKA)信号传导途径,促进了癌细胞生长和血管生成。后来研究证实,在各种不良生命事件的发生过程中,哺乳动物免疫细胞显示出对逆境的保守转录反应(CTRA),这一反应导致包括白IL-6在内的许多促炎基因的表达增加。压力导致β2-肾上腺素能受体上调并促进了白细胞CTRA基因表达动态的促炎成分。目前已经证明β2-肾上腺素能受体拮抗剂能抑制IL-6表达。在几种类型的癌症中能检测到促炎细胞因子IL-6水平升高,IL-6水平升高与卵巢癌患者的抑郁,疲劳有密切关系。
目前的证据显示IL-6在神经病理学应激和神经免疫调节中具有重要的作用,而且卵巢癌患者的复发与否与IL-6存在密切关系,卵巢癌患者1年内未发生复发性疾病的IL-6水平是正常的。此外IL-6也是物理应激源的先天性炎症反应的效应分子。研究显示在早年生活中有不良经历的个体与没有早年生活逆境的对照相比,具有更高的急性IL-6释放和更高的IL-6浓度。有报道称在经典霍奇金淋巴瘤(cHL)患者确诊4年前就出现过IL-6表达的升高。前列腺癌研究中发现IL-6在体外和体内促进了细胞增殖并抑制了癌细胞凋亡,而且已经确定未经治疗的转移性或去势抵抗性前列腺癌患者血清中IL-6表达水平升高,而且还与肿瘤存活率和化疗反应呈负相关,在喉癌患者的血清检测发现其IL-6水平高于正常人,血清IL-6水平与此类癌症的进展显著相关。总之,较低的抗压力可能通过上调IL-6表达而导致癌症患者的死亡率增加。这些证据表明IL-6可能被用作临床预测模型中癌症风险分层,筛查和早期诊断的生物标志物[23]。
最新的一项重磅研究发现了压力和癌症发生发展有密切关系。我们知道压力增加的时候肾上腺皮质分泌的糖皮质激素会显著增加,糖皮质激素分泌的增加降低了化疗的效果,促进了癌症的转移,在相关动物模型中证实,糖皮质激素水平升高导致了其受体活性的增加,引起了癌细胞定殖和异质性的增强[24]。
目前的这些研究证据充分说明了具有情绪恢复能力和压力管理的癌症患者的策略应该纳入到旨在促进癌症患者的福祉和心理恢复能力的定制干预措施中。
九、饮食和癌症发生发展转移的关系
文章前面谈到了循环系统的重要性,而循环系统则依赖于消化系统,消化系统又依赖于饮食,包括免疫细胞在内的所有细胞、组织和器官都必然依赖于营养的传递与供应所形成的物质和能量平衡。营养物质经过胃肠系统的消化和吸收,再经由循环系统输送到机体的所有细胞,为细胞的代谢、调节与生命活动提供基本能量、物质和信息需求,在它们之间形成物质、能量和信息交流网络。营养是代谢的基础,而代谢则是一切生命活动的基础,癌症的发生和发展都伴随代谢的失调和紊乱,代谢的严重失衡反过来促进癌症的进展和转移。
通过饮食控制能够对代谢产生影响,这种影响是通过食物中的各种营养和功能成分与消化道系统的细胞、受体之间相互作用发生的。来自BIDMC癌症医疗中心一个研究小组发现了亮氨酸与ER+乳腺癌中他莫昔芬耐药性的关系,研究表明降低亮氨酸水平可以抑制肿瘤细胞的增殖,而增加亮氨酸可以增强肿瘤细胞的增殖,这一研究揭示了低亮氨酸饮食可能对ER+乳腺癌患者有益[25]。动物蛋白质与植物蛋白质相比,具有更高的亮氨酸含量,因此本研究也确定了一种帮助ER+乳腺癌患者的饮食干预策略。先前的研究发现食物来源的摄入RNA被线虫和昆虫的消化系统吸收,并且可以控制这些生物体中基因的表达,最近的证据表明,类似的现象可能发生在人类和其他哺乳动物身上,来自食物的植物miRNA被哺乳动物消化道细胞吸收并包装成微泡,从而保护它们免于降解,然后通过血流将miRNA运输到多种组织,在那里它们能够调节哺乳动物基因的表达。下边我们来看几个饮食和癌症关系的例子。
研究发现冻干浆果可以抑制啮齿动物的消化道癌症。浆果在肿瘤发展的起始和进展阶段均有效,浆果通过影响致癌物质代谢来抑制肿瘤,导致致癌物质诱导的DNA损伤水平降低。它们通过降低恶变前细胞的生长速率,促进细胞凋亡,减少组织炎症参数和抑制血管生成来抑制癌症进展。分子机理研究显示浆果调节参与增殖,凋亡,炎症和血管生成的基因的表达。毒性研究的结果表明,当以45g/天的剂量口服给药7天时,冷冻干燥的黑莓在人体中具有良好的耐受性。目前在食道癌和结肠癌高风险患者中正在进行几项IIa期临床试验,以确定浆果是否会调节这些疾病发展的各种组织学和分子生物标志物[26]。
先前有研究将人们食用红肉与一些癌症(结肠、乳腺、前列腺、卵巢和肺癌这些癌症)联系起来。研究发现牛肉、猪肉和羊肉中存在一种名为Neu5Gc的糖类分子,人体会将这种分子视作外来物质而产生抗体并介导炎症反应的发生,长此已久就会导致肿瘤的形成。此外在全脂牛奶、某些奶酪和鱼卵中均含有Neu5Gc。大多数哺乳动物体内都能产生Neu5Gc,因此不会产生相应的抗体,但人体中不会产生这种糖类分子,而被认为非己成分而启动免疫攻击,这一定程度上解释了为何人类得癌症的几率比其他食肉动物高的原因[27]。
来自美国德州大学西南医学中心儿童研究所的研究人员进行了一项研究发现相比于正常细胞,癌细胞从抗氧化物得到的获益更多,这一发现增加了人们对于癌症病人食用饮食中抗氧化物的担心。癌细胞转移是癌细胞从原发部位传播到身体其他部分的过程,是导致多数癌症病人死亡的重要原因。该研究团队在黑色素瘤的研究中发现对癌症小鼠模型进行抗氧化物处理会使癌细胞扩散更快[28]。
关于癌症药物研发和治疗策略的思考
癌症并不只是一个局部的疾病,而是一个系统疾病和全身性疾病。癌症的形成经历了较长时间的发展变化,是机体长期代谢失衡的结果。癌症耐药复发和转移导致了癌症治疗的失败。前面我们具体分析了癌症复发转移影响因素,每一大方面下又有许多小的影响因素,文中仅仅列举了最近几年发现的一些代表性例子,随着对癌症研究的不断深入,人们发现了许多大家以前未成想到的癌症耐药、转移和复发的途径,阐释了癌症耐药、复发及转移逃逸的分子机制,以后必将发现更多的癌症逃逸机制,这些纷繁复杂、令人眼花缭乱的癌症逃逸途径充分说明癌症的发生发展以及复发转移是多因素共同作用的结果,这是一个动态变化的长期过程,如何消除这些因素的影响对于抗癌药物的研发和癌症的康复治疗具有重要意义。
近几年来随着人们对癌症发生、耐药及复发转移机理的深入研究,开发了一系列针对癌症的靶向疗法以及针对不同靶标的免疫疗法。癌症靶向药物主要有以下几类:
1、血管生成抑制剂;
2、针对癌细胞生长转移所依赖的不同信号通路的抑制剂;
3、癌症相关的蛋白酶、磷酸酶或激酶抑制剂;
4、降解和癌症发生发展及转移信号通路中关键蛋白的小分子;
5、针对癌细胞表面特殊蛋白的抗体和小分子药物;
6、针对癌症微环境或代谢通路中关键分子的抑制剂。
癌症免疫治疗药物和疗法主要有以下几类:1、免疫治疗相关蛋白、抗体及小分子;2、免疫细胞疗法;3、溶瘤病毒和细菌疗法;4、癌症疫苗。这些癌症治疗药物和治疗方法囊括了目前癌症发生发展耐药以及癌症复发转移的各个方面,对于癌症的治疗产生了积极深远的影响,人们希望这些药物和疗法能彻底治愈癌症,但是现实情况告诉我们,虽然开发的癌症治疗药物和疗法众多,但实现真正意义上的治愈并不出现复发转移的病例还很有限,有不少药物只对小部分患者起反应,有不少患者治疗一段时间后出现了耐药复发和转移。大家对这些现象是否有一些思考?
癌症耐药、转移复发的影响因素很多,理论上针对每一种影响因素和机制就可以开发抗癌药物,也可能取得一些疗效,但是要实现针对大多数癌症治疗的长期效果和无复发还有一定困难。癌症是一个系统性全身性疾病,是一个长时间的积累变化而发生的疾病,对于癌症药物开发我们可以从上述众多影响因素中抓主要的矛盾和主要的影响因素,既抓一些主要的方面又关注一些重要的点,做好点面的配合和组合,以这样的策略去开发癌症治疗药物和疗法有可能取得一些更好的效果,同时需要重视不同药物、治疗方法的组合运用。目前发展的一些组合治疗方法应该是癌症治疗的一个方向,但是不同药物和疗法在剂量和用药时间及先后上如何组合,如何评价效果是需要我们深入研究和思考的问题。(参看之前发表的公众号文章:“癌症免疫及组合疗法,治愈癌症的希望?”)
关于癌症病人的治疗方案选择是一个大家长期讨论的话题,如何选择治疗方案才能很好的控制癌症的复发转移,让癌症成为慢性疾病使癌症病人长期获益提高癌症病人的生活质量?从前面我们阐述的癌症复发转移的几大影响因素分析来看,要实现上述目标,我们应该通盘考虑、整体设计,采用综合的治疗方式。首先对于癌症病人治疗及康复过程中需要进行情绪管理和压力控制。前面我们分析了压力促进癌症复发转移的研究,减压对于癌症病人的治疗和康复极为重要,贯穿于癌症病人治疗和康复的始终,目前国内外对于这方面也做了很多研究和尝试,将正念干预用到癌症病人的治疗和康复中取得了一定的效果。其次癌症病人治疗和康复过程中要注意饮食和营养的管控和设计。前面分析了饮食和癌症发生发展的关系,饮食是我们乃以生存的三大营养成分的来源,饮食、营养和免疫代谢及癌症代谢密切相关,对于癌症病人的治疗康复具有重要的影响。
最后对于不同癌症病人采取不同的药物和治疗手段进行综合治疗:目前组合疗法已经成为癌症治疗的共识,进入临床研究阶段的组合疗法也很多。关键是需要针对不同癌症病人以及癌症治疗的不同阶段适时采用不同的治疗药物和方法,不同治疗方案和药物如何更好的配合能够达到更好的效果,充分考虑治疗药物在剂量上的搭配和时间上的组合,以达到不同治疗方法及治疗药物的优势互补,充分考虑不同药物和疗法的正向作用和负向作用,尽可能的降低治疗的副作用,提高治疗效果。总之,希望通过以上各方面的共同努力,使癌症成为慢性病,使癌症病人病情长期稳定,生活质量显著提高。
过往文章:
参考文献
[1] Melanoma-intrinsic β-catenin signalling prevents anti-tumour immunity Nature 2015.
[2] ALK phosphorylates SMAD4 on tyrosine to disable TGF-β tumour suppressor functions. Nature Cell Biology 2019.
[3] Neutrophil extracellular traps produced during inflammation awaken dormant cancer cells in mice.Science 2018
[4] Cell-based screen identifies a new potent and highly selective CK2 inhibitor for modulation of circadian rhythms and cancer cell growth.Sci Adv 2019
[5] Tumor-secreted miR-214 induces regulatory T cells: a major link between immune evasion and tumor growth.Cell Res 2014
[6] Cancer exosomes perform cell-independent microRNA biogenesis and promote tumorigenesis.Cancer cell 2014
[7] Chemotherapy elicits pro-metastatic extracellular vesicles in breast cancer models.Nature Cell Biology 2018
[8] Membrane insertion andsecretion of the Engrailed-2 (EN2)transcription factor by prostatecancer cells may induce antiviralactivity in the stroma.Sci Rep 2019
[9] Secreted PD-L1 variants mediate resistance to PD-L1 blockade therapy in non–small cell lung cancer[J]. Journal of Experimental Medicine 2019
[10]Rituximab (monoclonal anti-CD20 antibody): mechanisms of action and resistance. Oncogene 2003
[11]NOTCH decoys that selectively block DLL/NOTCH or JAG/NOTCH disrupt angiogenesis by unique mechanisms to inhibit tumor growth. Cancer discovery 2015
[12]肿瘤微环境中髓系抑制性细胞的研究进展2014
[13]Precise Spatiotemporal interruption of Regulatory T-cell-mediated CD8+T-cell suppression Leads to tumor Immunity.Cancer cell 2019
[14]Visualization of immediate immune responses to pioneer metastatic cells in the lung.Nature 2016
[15]The Emerging Hallmarks of Cancer Metabolism.cell metabolism 2016.
[16]T cell stemness and dysfunction in tumors are triggered by a common mechanism.Science 2019
[17] Cellular censuses to guide cancer care.Nature 2019
[18]Free fatty acids rewire cancer metabolism in obesity-associated breast cancer via estrogen receptor and mTOR signaling.Cancer research 2019
[19]Subversion of Systemic Glucose Metabolism as a Mechanism to Support the Growth of Leukemia Cells. Cancer Cell 2018
[20] Mining the microbiota for microbial and metabolite-based immunotherapies. Nature Reviews Immunology 2019
[21] Chronic stress in mice remodels lymph vasculature to promote tumour cell dissemination.Nat Commun. 2016
[22] The critical role of AMPK in driving Akt activation under stress, tumorigenesis and drug resistance.Nat Commun. 2018
[23]Stress resilience and survival among cancer patients: is there any absolute truth?Cancer Chemotherapy and Pharmacology 2019
[24] Glucocorticoids promote breast cancer metastasis.Nature. 2019
[25] LLGL2 rescues nutrient stress by promoting leucine uptake in ER+ breast cancer.Nature 2019
[26]Cancer prevention with freeze-dried berries and berry components。Semin Cancer Biol. 2007
[27] A red meat-derived glycan promotes inflammation and cancer progression.PNAS 2015
[28] Oxidative stress inhibits distant metastasis by human melanoma cells.Nature 2015
发布者:药时代,转载请首先联系contact@drugtimes.cn获得授权

 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
