新药分子的发现一直是非常有趣的话题,几乎每个新药分子发现的背后都有一个扣人心弦的故事。这些神奇的分子有的来源于天然产物,有的来源于偶然的错误实验,有的来源于药物学家天才的创意等等。我们在调研新药开发企业的过程中对此也深有感触,创始人每谈及自己的新药分子,宛如介绍自己的孩子,总是那么饱含深情,甚至等不及我们发问,就会把分子发现过程的娓娓道来。(一家之言:如果创始人对自己candidate的分子发现由来过程吞吞吐吐或者遮遮掩掩,那么作为投资人你可以开始打负分了。)
在当前医保控费和带量采购的大背景下,单纯的仿制药利润微薄,Me Too药物竞争惨烈,只有开发差异化的创新药并参与全球市场竞争才是国内创新药研发企业未来发展的希望之路。至此,国内的一些资金实力和创新能力较强的大药企尚可放手一搏,但对于众多资源束缚严重的中小型企业,是否还有发现新药分子的机会呢?
答案当然是肯定的。
本篇文章就给大家介绍一个新药发现的利器——DNA编码化合物库技术。
DELT与药物发现:新药分子来源分析
为了让大家对DNA编码化合物库技术(DNA Encoded Compound Library Technology,简称DELT),当前所处的地位有一个全面的认识,我们先带大家回顾分析一下最近药物分析发现的现状。
新药分子到底从何而来?
这是每个新药研发团队都会面临的核心问题。我们一直想把新药分子的来源做一个客观分析,但是苦思许久,也没有得出个像样的统计结果。
非常幸运的是,一名阿斯利康的科学家近期发表的一篇文章《Where Do Recent Small Molecule Clinical Development Candidates Come From?》为我们揭开了困惑已久的谜底[1]。
这篇文章从对2016-2017两年间发表在J.Med.Chem期刊上的66个临床候选化合物的来源进行了统计分析。在对统计结果进行分析之前,我先将先导化合物发现常用的策略分享给大家,主要有六种:高通量筛选(HTS)、定向筛选(Directed Screen)、基于结构的药物设计(SBDD)、基于分子片段的药物设计(FBLG)、DNA编码化合物库(DEL)以及已知活性化合物(Known)。大家可能对已知活性化合物作为一个新药分子的来源感到疑惑,其实这种方法是药企常用的方法,比如用于治疗非小细胞肺癌(NSCLC)的第三代EGFR-TKI抑制剂——奥希替尼,其先导化合物就是来源于阿斯利康公司内部的已知活性化合物库。
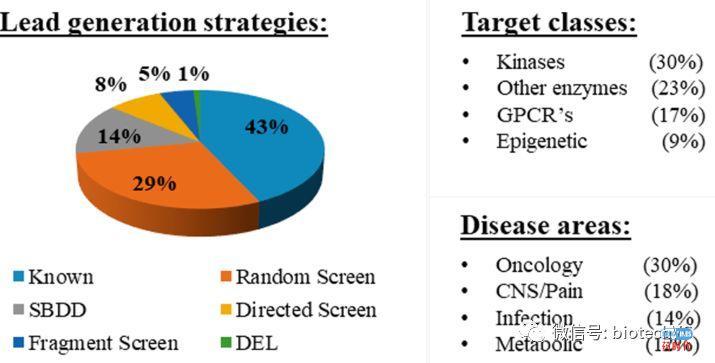
上图是文章的统计结果,66个临床候选化合物的发现策略应用情况为:Known(43%)、HTS(29%)、SBDD(14%)、Directed Screen(8%)、FBLG(5%)、DEL(1%)。以上这个结果大家可能感到意外,新药分子的主要来源仍然是已知活性化合物,这也和我们之前的文章《我们还有星辰和大海》中阐述的药物分子来源现状基本一致:“业内的药物化学家年复一年地围绕基本化学骨架做着相对较小的改动,临床候选药物及其后备化合物常常都出自同一个骨架类型。”从以上的结果我们还可以看出,除了已知化合物,稳坐新药分子的发现技术第一把交椅的是我们熟知的高通量筛选,相比其他技术占据了绝对优势。
由此可见,新药的研发并没有传说中的那么妙趣横生,偶然发现毕竟是少数,新药的主要来源仍然靠耗时耗力耗财的高通量筛选(HTS)。可悲的是大规模的潜在新药分子的化合物库几乎被国外大公司垄断,且随着大规模的企业并购愈发集中,比如Roche在收购Genentech之后,自身的化合物库从100多万个扩张为240多万个。国内只有少数重视研发的药企有自己的小型化合物库,但规模跟国际大药企不可同日而语。其他很多中小厂家都在忙着做仿制药,哪有心思积累自己化合物库呢?
那没有了化合物源头,企业新药发现的理想会不会变成空想呢?
正如我们开篇所说,绝对不会!技术的发展就是这样,哪里有垄断,哪里就必然会出现颠覆性的新技术。我们欣喜地从文章统计结果中看到了那个对新药分子发现贡献只占1%的新技术的身影:DNA编码化合物库(DEL)。没错,就是那个因为实用性的问题被工业界质疑了十多年的DELT。
文章的作者在结尾处自信的说到:Other strategies also have demonstrated impact (e.g., FBLG and DEL), and their full potential may yet be realized.。可见DNA编码化合物库的已经被证明有效,并再一次受到了科学家们的重视。
下面我们就带大家深入了解这个快速发展的新技术。
DELT的历史进程:技术的起源与发展
说了这么多,那到底什么是DELT技术呢?DELT如何操作?DELT的发展历程是什么样的?别急,我们慢慢展开来讲[2]。
DELT技术最早由美国Scripps研究院的Sydney Breener(2002年诺贝尔生理与医学奖获得者)和Richard Lerner(时任Scripps研究所所长)于1992年提出。DNA编码化合物类似于将DNA片段作为一种记录化合物结构信息的条形码,在包含数亿化学分子的化合物库中,每一个分子都由一条独特的DNA片段连接,实现对化合物库中每一个化合物进行编码。
下图是DELT筛选化合物的典型流程:
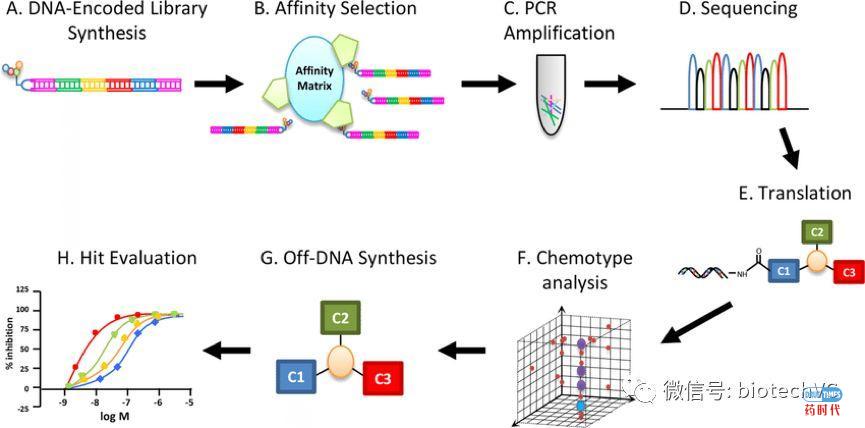
DELT的主要操作流程主要包括以下几个环节:A. DNA编码化合物库的合成;B. 靶向蛋白亲和力筛选;C. PCR扩增;D. DNA高通量测序;E. 编码翻译;F. 化学结构分析;G. 非编码化合物重新合成;H. 化合物与靶向蛋白生物活性验证。从以上的流程可以看出,DELT操作流程完善,科学验证严谨。
我们在阅读有关DELT的技术史料和科技新闻之后,把27年来与DELT相关技术的发展和转化进度做了一个简单的进程图,如下所示:
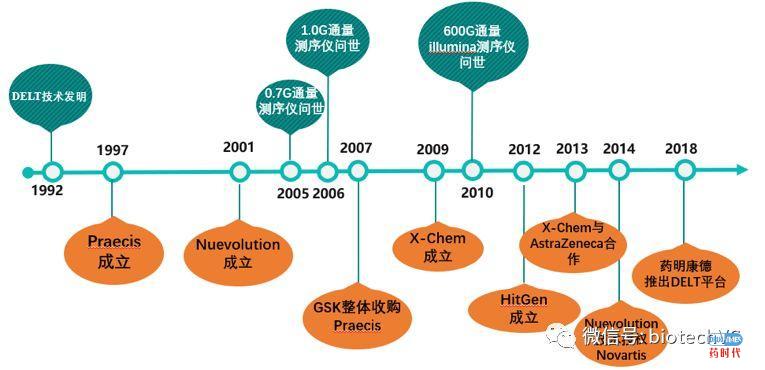
在上图中,时间轴上部绿色事件与技术进步相关,下部分橙色事件与产业转化相关。经济学家熊彼特认为,创新就是生产要素或生产条件的“新组合”。从DELT的操作流程和发展简史可以看出,DELT正是多个技术要素的集合,包括化学技术、生物学技术、测序技术、分析技术等多个技术的集合,这种新的组合赋予了DELT巨大的竞争优势,如高通量、短周期、低成本等。
基因测序技术,尤其是第二代测序技术(NGS)的发展,极大的提高了DELT的生产效率,以DELT为核心技术的企业不断涌现,对外合作不断增加(为了简化图形,很多企业的对外合作暂未列入),这充分说明了技术转化落地正在加速,越来越多的工业界人士开始认识到DELT潜在的价值。
DELT的建库方法:合成策略不断迭代
在介绍了DELT的基本概念和流程之后,我们把焦点转到DELT最核心的部分:DNA编码化合物库的构建[2-3]。可以说,从DELT发明的那一刻起,科学家们就从来没有停止过对于建库策略和反应的研究,其中化学家为推动DELT的发展做出了非常大的贡献。下面我们就对主要的合成策略做一个梳理。
第一个登场的是DNA记录合成法(DNA-recorded Synthesis),组合化学的出现早于DELT,最开始应用在多肽的固相合成策略中。DELT的建库策略最开始就是借用了组合化学的合成方法,即使发展到现在也仍然以DNA记录合成法为主,那到底DELT是如何利用组合化学法建库呢?请看下图:
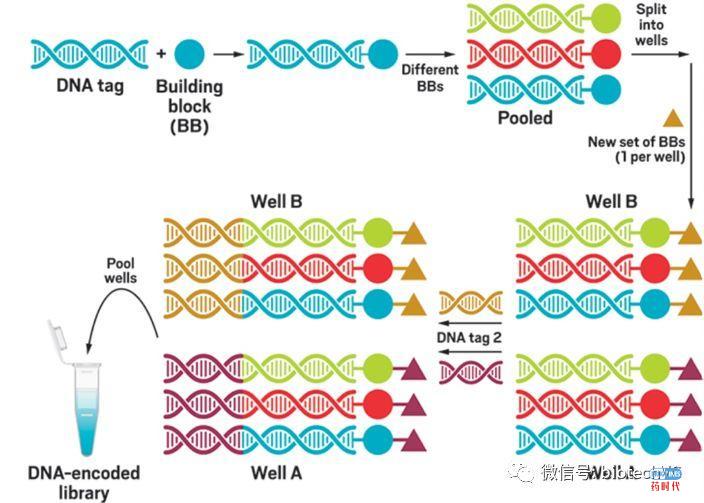
组合化学合成法的核心是“Split & Pool”(即均分与合并)方法在化学合成中的使用。如上图所示,我们将三种不同的BB(Building Block)连接不同的DNA编码片段,将这一一对应的三种化合物混合,然后均分为两个平行反应组,一个反应组连接同一种BB的同时在DNA编码区连接同一新的编码片段,另外一个反应组取连接另外的BB和对应的DNA片段。反应完毕后,将两个反应组的化合物混合,得到化合物的数量是3×2=6种,每种化合物都有一一对应的DNA片段,这就是组合化学方的基本原理。比如,当每一种BB有1000个时,一个三步反应的化合物库可以通过1000+1000+1000=3000组化学反应合成1000×1000×1000=109,即10亿个化合物的库。
第二个是DNA模板法(DNA-templated synthesis,简称DTS),这个方法的发明人是哈佛大学年轻的华裔科学家David R. Liu教授[4]。该方法的主要是利用DNA双链的互补性,增大化学反应底物的局部浓度,从而使反应某些化学反应或构建特定结构(比如大环化合物)更加有效。DTS的合成原理图如下所示:
DTS的合成原理图如下所示:
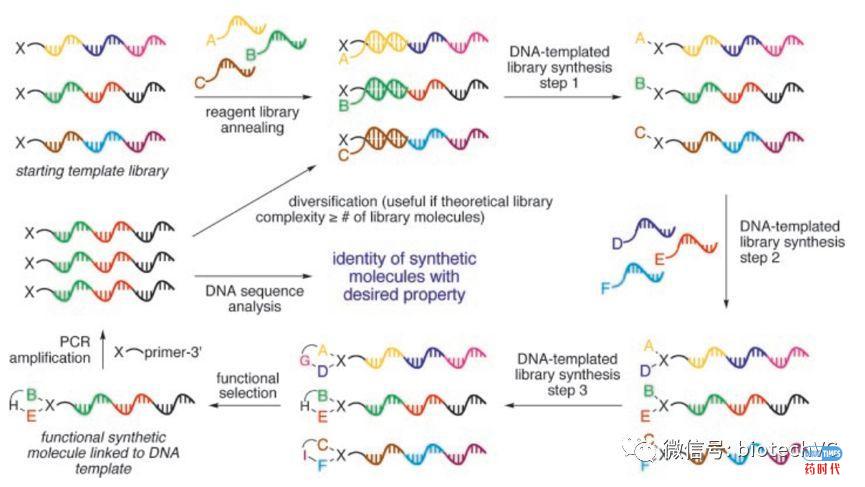
从上图可以看出,DTS构建大环化合物库的策略主要依靠单链DNA之间的配对互补效应拉近化合物反应位点的空间距离,进而实现大环化合物的合成。这是一种非常聪明的构建策略,获得的成果于2004年发表在Science期刊上。另外,David R. Liu以DTS的核心技术创立了新药开发公司Ensemble Therapeutics,专注于构建大环类化合物,但是很遗憾,据报道该公司已于2017年底悄然关闭。
虽然DTS法是构建大环化合物的首选技术,但其采用的是单链DNA片段,这种方法存在两个先天性的不足,一个是当DNA单链的长度增加时,反应的活性中心离上一步的反应位点越来越远,反应难度增加;还有一个问题是,单链DNA非常容易扭曲,形成类“发夹”结构,可能会包裹住活性位点,在化合物筛选时容易出现假阴性的结果。于是,一种叫做YoctoReactor合成技术出现了[5],目标就是要解决上述两个问题,该反应的原理图如下所示:
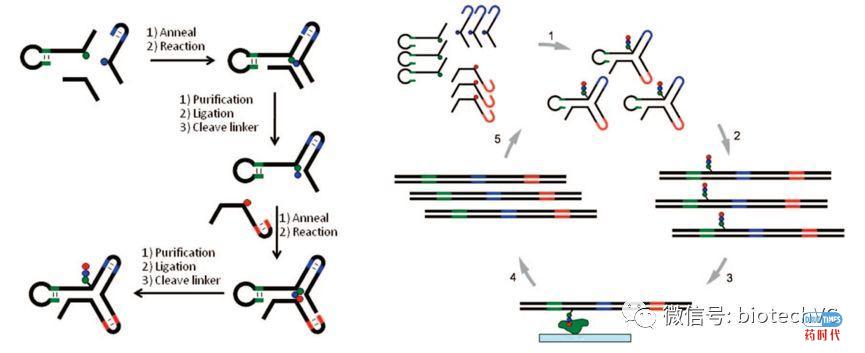
该反应的具体原理我们在此就不做赘述了,感兴趣的朋友可以查阅相关的文献研究。根据公开信息,目前也有一家公司以该方法为核心技术平台,丹麦的Vipergen。
当然还有其他合成方法,如DNA routing合成法、ESAC合成法等等,相关的书籍或综述文章里对这些反应都会有详细的介绍。我们用这么长的篇幅介绍化合物库的合成策略,主要是想说明化学家正在为丰富DEL中的分子种类和空间构型持续努力着,这一切都是在弥补DEL的短板。总之,DELT在科学家的努力下会变得更加实用与高效。
DELT的筛选成果:好的技术可被验证
DELT由于其实用性问题被工业界质疑了很多年,这期间伴随着多个公司的成立、转让、倒闭。比如,最开始成立的Praecis于2017年被GSK整体收购,Nuevolution技术于2014年非独家授权给Novartis使用。虽然DELT应用之路充满艰难险阻,但这并不能阻止一代代的科学家和企业家为DELT的进化努力。在这里我们跟大家分享另外一个数据分析图[6]:
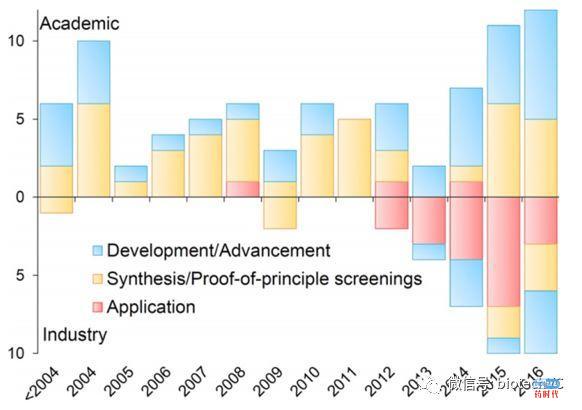
这张图分析的是从2004年到2016年这十几年中所有关于DELT的公开发表的文章的数量,其中蓝色部分指的是专注DNA编码化合物合成方法研究的文章;黄色部分是指化化合物库的合成和DELT的筛选应用;红色部分是指通过DELT筛选出分子之后继续对分子进行优化。我们通过以上的数据也能看出,从2010年以后,DELT的实际应用正在逐年增加。
那究竟有多少个通过DELT技术发现的有生物活性的化学分子呢?2017年,Robert Goodnow博士在Nature上发表的题目为《DNA-encoded chemistry: enabling the deeper sampling of chemical space》的review中帮我们做了一个统计[3]。
文章总结了从2014年3月到2016年6月期间所有公开报道的通过DELT技术发现并优化的活性分子。统计结果显示,这期间共有19个活性分子来源于DELT技术。在这些成果中,工业界的贡献占了绝大部分。其中制药GSK贡献了12个,占比69%,远超X-Chem、Ensemble和Vipergen,这也说明了GSK通过5500万美金收购的Praecis使其在DELT方面的技术实力成为毋庸置疑的全球一哥。
我们根据研发机构成立时间以及对外合作的情况,并参考相关文献报道以及新闻资讯等信息,对目前的DELT的全球竞争格局做了一个简单的梳理,如有不妥之处欢迎指教。
排在首位的仍然是GSK,它在DELT领域的历史最为悠久且有多个化合物进入临床阶段,但是GSK的技术只供其自身使用,并不对外开放;随后以化合物库的规模、商业合作伙伴以及行业认可度来看,应该是X-Chem、HitGen(成都先导)和Nuevolution;当然,后起之秀也不断涌现,包括Vipergen、DICE、Philochem、WuXi AppTec(药明康德)、Pharmaron(康龙化成)等。相信大家看完竞争格局后会感到非常自豪,我国有三家企业已经步入全球竞争行列,尤其是成都先导,近期有很多关于其对外合作开发以及新药分子发现的报道,其技术实力已获得国内外同行的高度认可。值得一提的是,在成都先导的积极推动下,第8届DNA 编码化合物库技术国际高峰论坛于2018年10月在成都举办。
那我国这三家优秀企业的背后都有哪些大牛默默加持呢?不查不知道,一查吓一跳,这三家公司的首席科学家来头可都不小。
成都先导的首席科学家是大名鼎鼎的Barry A. Morgan,他是原Praecis的核心成员,是DELT工业化技术的主要发明人,可以说是DELT的鼻祖之一。Barry A. Morgan在Praecis被GSK收购后,任新药分子的发现部门的负责人。除此之外,GSK的好几位大咖如David Israel等也已加盟HitGen。我们相信他们在Praecis和GSK的丰富的药物开发经验必将给先导未来的发展带来巨大的帮助。
同时,国内两家做CRO出身的两家知名企业药明康德和康龙化成也不容小视。药明康德旗下的药明生物于2018年9月25日宣布哈佛大学化学与化学生物系教授刘如谦(David R. Liu)加盟公司科学顾问委员会。David R. Liu?没错,就是上文介绍的发明模板法合成大环化合物技术的发明人。此人到底有多厉害,由于篇幅限制,我们只能简单描述:哈佛学霸,化学天才,研发成果入围2017年年度《科学》杂志评选的四大突破。
康龙化成也不甘示弱,早在2016年10月就邀请Robert Goodnow博士加入康龙化成担任创新化学副总裁,就是上面提到的在Nature上发表DELT综述的第一作者,同时他还主编完成了“A Handbook of DNA-Encoded Chemistry”一书[2],当然这个牛人也拥有Roche和AstraZeneca多家顶级药企的豪华履历。药明康德和康龙化成这类CRO背景的公司有深厚的化学合成背景,有大量的药物开发试验数据,再加之国际大牛的加持,发展前途风光无限。
DELT优势与挑战:过去未去未来已来
一个技术从诞生到落地再到开花结果总是需要很长的周期,需要等,而这一等就等了将近30年。时至今日,我们终于看到了DELT近几年取得的成果,也认识到了颠覆性技术强大持久的生命力。
DELT和HTS的对比永远是一个绕不开的话题。跟HTS相比,DELT在化合物数量、灵敏度、筛选周期以及耗用成本等方面的具有无法比拟的优势。但是DELT特殊的合成和筛选策略也使其有一些先天不足,比如化合物库结构类型的限制,比如DNA编码片段带来的合成方法的限制,比如化合物筛选模型的限制。下面我们对这三个主要的问题做一个简要的回答:
第一个问题是关于结构类型的限制,这个问题还有另外一种问法,即数量和质量到底谁更重要?
我们评价DEL化合物库的常用标准往往是化合物数量,很多人认为数量高达几百亿的DEL化合物库一定比数量仅为千万或百万级别的好得多。当然,这种观点经常受到批判,很多人呼吁要从质量上评价DELT,构建模块(BB)选择一定要新颖,如果BB只选择各类氨基酸,那么即使DEL数量庞大,实际筛选效果也不会好,因为化合物的结构太相似了。
我们的观点是:数量和质量都很重要,两者是相互促进的。我们不能一味的追求数量而忽略了结构的新颖性,也不能只重视结构的新颖性而忽略了数量。因为你有时根本无法预测那种结构会有更好的结果,一个小基团甚至一原子的改变就可能带来意想不到的生物活性,就有可能成就一个新药。这可不是凭空猜想,我们也是在阅读大量文献后发现的这个有趣的现象。
第二个问题,DNA编码片段带来的合成方法的限制。
这是一个老问题了,DEL建库的化学过程由于DNA片段的存在,大部分需要在质子型溶剂(比如水、醇类)的环境中进行,一般反应条件pH要大于4,要尽量避免强酸、强氧化还原试剂、强活性试剂或中间体。但是仍然有很多的反应比如温和的氧化还原反应、酸胺缩合反应、还原胺化反应、亲核取代反应、交叉偶联反应、环加成反应等等几十个反应类型得到了探索和应用。而且化学家也正在不遗余力的开发新的反应类型,比如酶催化反应、光氧化还原等,从这二十多年发的文章就知道化学家们有多努力。当然,解决这个问题还有另外一个途径,可以把需要苛刻反应条件的化学反应应用在BB的合成过程中,建库过程只需要把不同类型的BB组合连接即可。
第三个问题,关于化合物筛选模型的限制。
这个限制确实存在。HTS筛选模型包括两大类,一类是分子水平的药物筛选模型,包括受体筛选模型、酶筛选模型、离子通道筛选模型等等;一类是细胞水平药物筛选模型,包括、内皮细胞激活、细胞凋亡、抗肿瘤活性、信号转导通路、细菌生长等等。DELT与之相比,在纯化蛋白模型上的筛选相对比较成熟,但在细胞水平的药物筛选上比较局限,细胞水平筛选往往需要基因工程的帮助,目前正在探索之中[7]。当然,随着分子生物学的发展,越来越多的细胞通路和分子靶点会被发现和证明,这个大趋势不可逆转,DELT在分子水平的筛选将大有可为,也将大大提高后续细胞筛选的成功性。
过去未去,未来已来。
虽然HTS的筛选方法至今是新药物分子筛选的首选,但随着科学家的不懈努力,DELT一定会逐渐成长为与HTS并驾齐驱的助力新药分子发现的首选方法。
最后,以DELT的发明人Richard A. Lerner 和Sydney Brenner几句意味深长的话作为本篇长文的结尾。这些话源自于两位老科学家在2017年的Angew. Chemie期刊的专栏文章《DNA-Encoded Compound Libraries as Open Source: A Powerful Pathway to New Drugs》[8],文中这样说到:
1.NIH(美国国立卫生研究院)每年花费300亿美金用于寻找治疗疾病的化学分子;
2.生物学家最大的问题是没有获得规模庞大的化合物库,高通量筛选是大药企的特权;
3.我们花费数十亿美元的巨资去发现新的靶向蛋白,但是却无法找到化学分子与其结合;
4.DELT将会高效的解决上述问题。
附视频:DEL技术发现新药原理(视频来源:Novartis)
最后,如果对我们感兴趣,可以加微信:kevincalm;如果你觉得本文尚可一读,还请转发朋友圈,让更多的朋友能获得新的启发。
扫描下方二维码,关注我们BiotechVC的订阅号。

以上文字由Biotech venture capital原创,仅为促进讨论与交流,不构成法律意见或咨询建议。版权所有,违者必究。如需转载,请注明作者和Biotech venture capital原创。
过往文章:
参考文献:
[1]. Dean G. Brown et al.Where Do Recent Small Molecule Clinical Development Candidates
Come From?J. Med. Chem.2018, 61, 9442−9468.
[2]. Robert A. Goodnow. A Handbook for DNA-Encoded Chemistry. Wiley, March 2014.
[3]. Robert A. Goodnow Jr, Christoph E. Dumelin, Anthony D. Keefe.DNA-encoded Chemistry: Enabling the Deeper Sampling of Chemical Space.Nature Reviews Drug Discovery 2017, 16, 131-147.
[4]. Zev J, Gartner and David R, Liu et al. DNA-Templated Organic Synthesis and Selection of a Library of Macrocycles.Science,2004, 305, 1601–1605.
[5]. Margit Haahr Hansen et al. A Yoctoliter-Scale DNA Reactor for Small-Molecule Evolution.J. Am. Chem. Soc. 2009, 131, 1322–1327.
[6]. Lik Hang Yuen and Raphael M. Franzini. Achievements, Challenges, and Opportunities in DNA Encoded Library Research: An Academic Point of View. Chem Bio Chem 2017, 18, 829 – 836.
[7]Zining Wu et al.Cell-Based Selection Expands the Utility of DNA-Encoded Small Molecule Library Technology to Cell Surface Drug Targets:Identification of Novel Antagonists of the NK3 Tachykinin Receptor.ACS Comb. Sci. 2015, 17, 722−731.
[8]. Richard A. Lerner and Sydney Brenner. DNA-Encoded Compound Libraries as Open Source:
A Powerful Pathway to New Drugs. Angew. Chem. Int. Ed.2017, 56, 1164 – 1165.
发布者:药时代,转载请首先联系contact@drugtimes.cn获得授权

 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
