
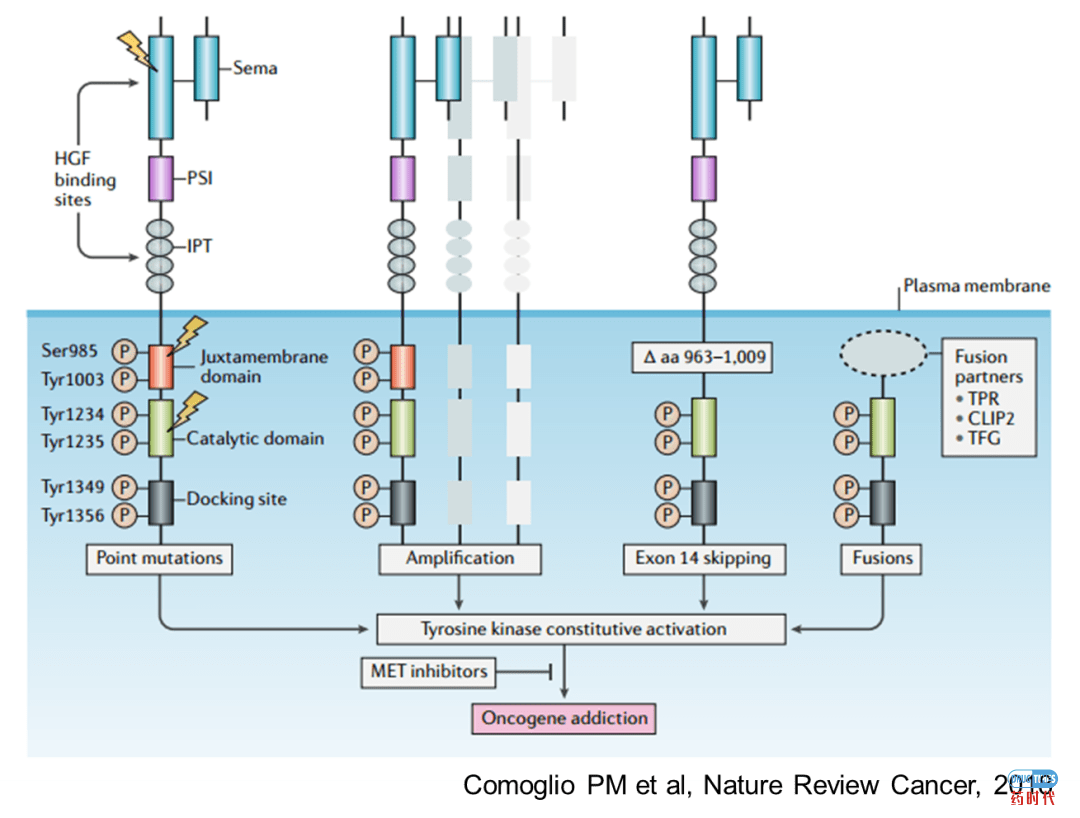
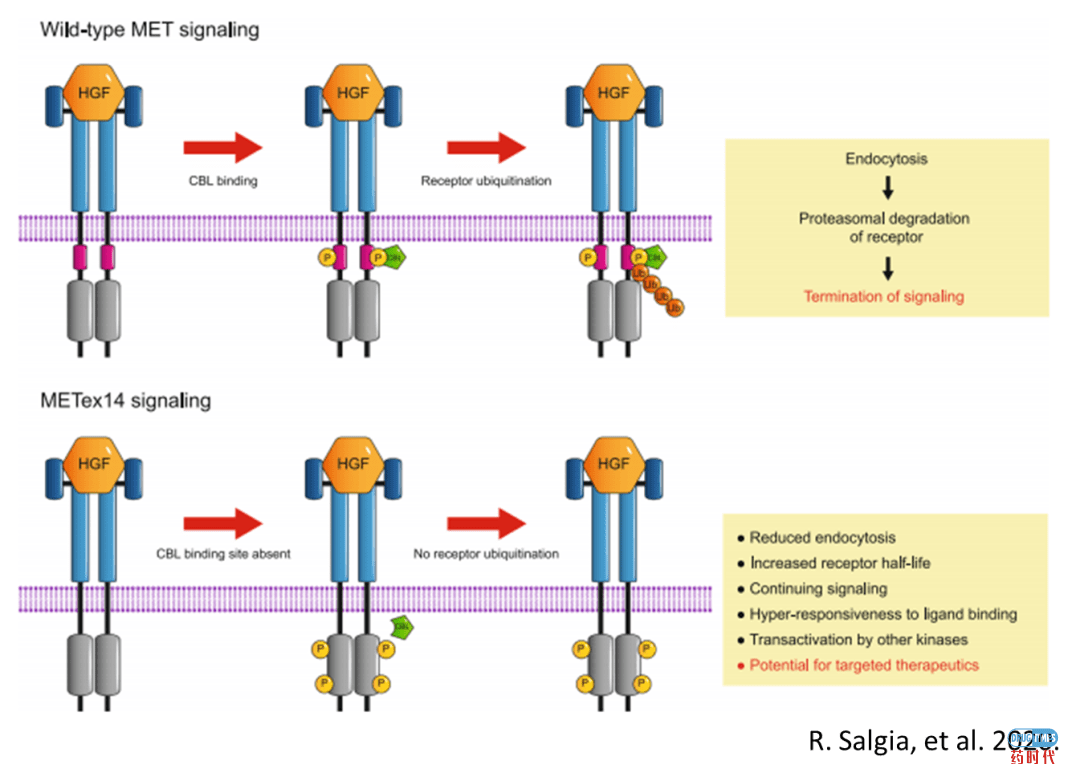
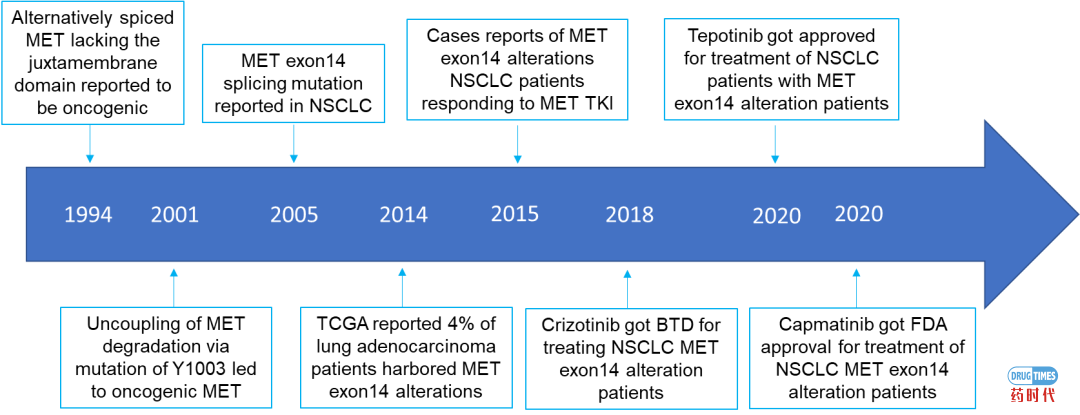
 MET structural alterations and oncogene addiction
MET structural alterations and oncogene addiction
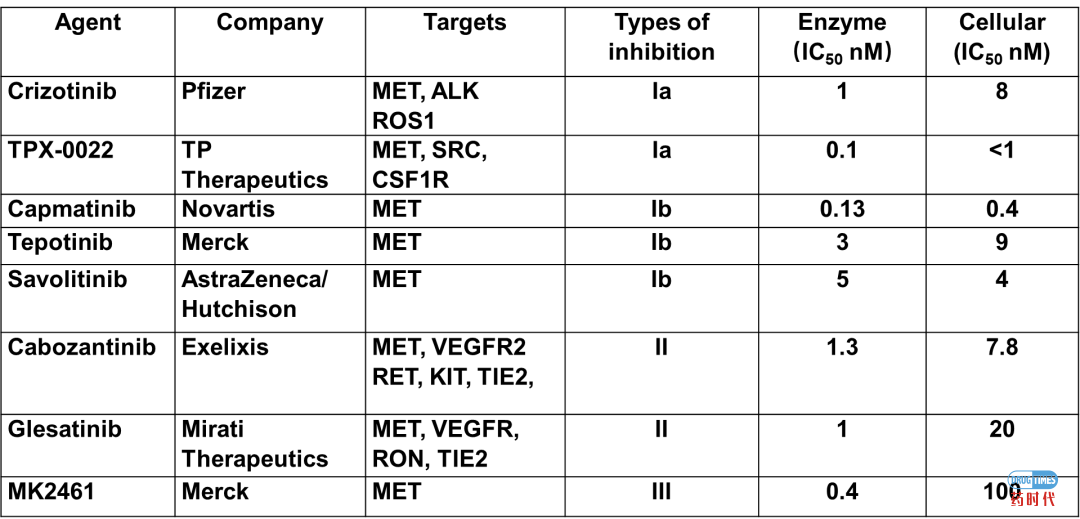
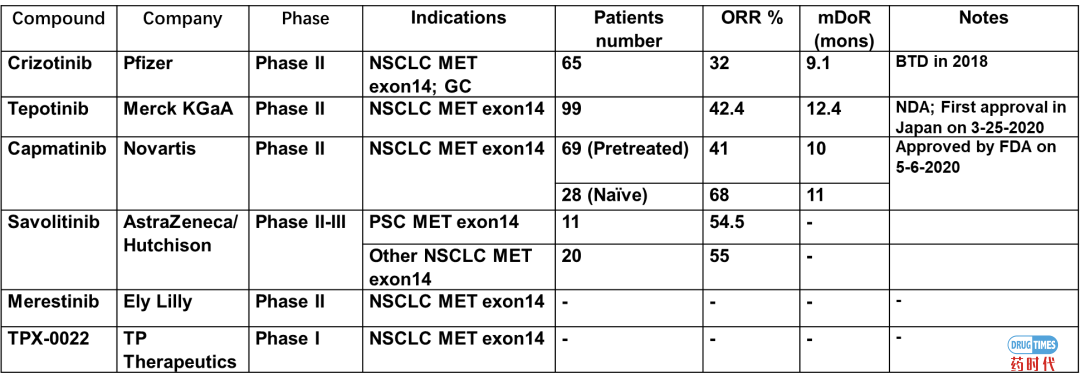
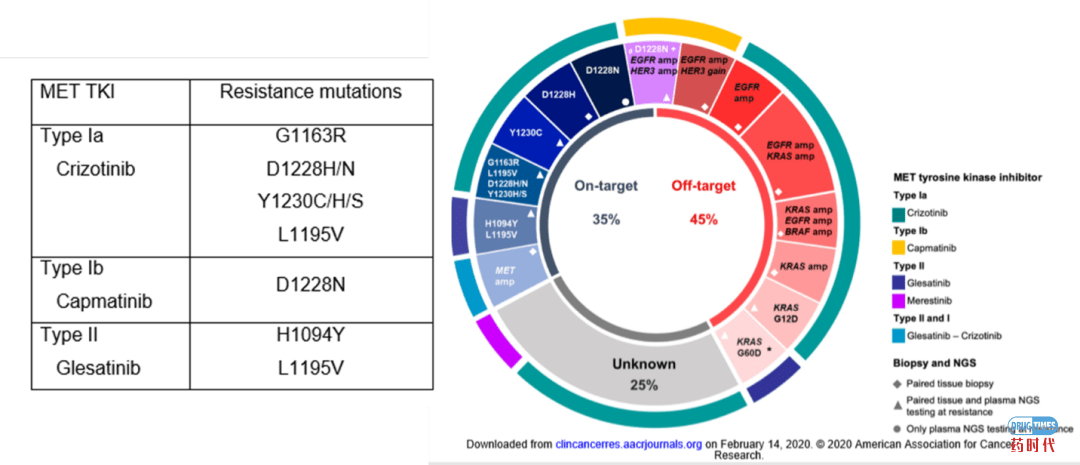
MET的小分子激酶抑制剂
参考文献
点击最下方阅读原文,欣赏紫薯博士专栏全部作品!


发布者:药时代,转载请首先联系contact@drugtimes.cn获得授权

 MET structural alterations and oncogene addiction
MET structural alterations and oncogene addiction

MET的小分子激酶抑制剂




参考文献
点击最下方阅读原文,欣赏紫薯博士专栏全部作品!


发布者:药时代,转载请首先联系contact@drugtimes.cn获得授权
 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来!
