前段时间,有小伙伴在公众号留言说能不能写点生物药的文章,不要老是小分子药嘛。难道你们团队里只有化学,没有生物?我们团队的生物大咖刘博坐不住了,闪开,我来做个分享,绝对干货!后面还要加卤蛋!(不对,是彩蛋! )
)
话不多说,直接开始:
1897年Paul Ehrlich 提出的“魔术子弹”( magic bullet) 假说是治疗性抗体药物概念的雏形。从提出这一假说至今,抗体药物的发展已经历了100多年(图1)。
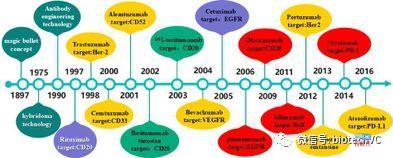
图1:抗体药物的百年发展历程
绿色为鼠源抗体,紫色为嵌合抗体,黄色为人源化抗体,红色为人源抗体
1986年美国FDA批准了第一个抗体药物Orthoclone OKT3上市,截止目前获FDA批准上市的治疗性单抗新药多达70多个,几百种治疗用抗体处于临床研发阶段。
就目前的统计数据显示,抗体药物的成功率高于小分子化学药物,抗体药物已在肿瘤、自身免疫性疾病领域获得了巨大的成功,目前抗体药物最重要的应用领域为自身免疫性疾病和癌症,随着对疾病机制理解和研究的深入,抗体药物已迅速拓展到眼科、抗感染、心血管等诸多领域。并且其适应症也越来越广,囊括了不同种类的癌症、骨质疏松、多发性硬化症和哮喘等诸多适应症。
治疗性抗体药物发展空间广阔,据相关资料预测到2021年全球治疗性抗体药物的市场能达到3200亿美元的规模,治疗性抗体药物具有巨大的市场容量和空间,对于创新型抗体研发企业,成功开发抗体药物是抗体研发企业的重要目标,同时也是抗体研发人员为之努力的方向。
那么成功的抗体药物开发首先应从哪方面考量呢?大家首先可能会想到的是抗体药物的疗效和副作用。
作为药,未满足的临床需求同样是抗体药物研发企业和人员最初需要考量的一个重要因素,也是治疗性抗体药物研发的始动因素和落脚点,任何创新如果偏离了临床需要都没有太大的价值和意义。
那么我们如何衡量未满足的临床需求?简而言之可以概括为以下2大方面:
(1)针对某种疾病,目前还没有治疗药物;
(2)针对某一疾病的药物,目前疗效还不理想或存在部分患者不可耐受的副作用。
当然这两大方面还可以进一步细化,真正临床需求的确认是需要经过大量的调查和数据分析得出的。抗体药物研发企业在某一方面能够做出真正满足和解决临床需求的差异化的产品,就是巨大的创新,在抗体药物研发和后期的商业化推广中就更可能获得成功。
大家注意,是否是真正的临床需求是需要研发企业充分调研不同医院的一线医生、病人及考察相关的产品、技术、市场等多个维度得出的综合判断。在我们接触的新药研发企业中也发现有的企业根本没有经过上述的访谈、调研和分析,就仅凭个别医生及资料的调查就认定自己开发的产品能满足临床需求解决实际问题,其实这样做出的结论是很不客观和真实的,对于这样的企业我们首先就会打上一个大大的问号。
为什么说这一点很重要,因为对于创新药企包括创新性抗体药物研发企业来说,这是一个方向性问题,涉及到后续的立项策略和靶标选择,如果方向错了就好比我们开车去一个目的地,走错了方向南辕北辙,无论如何都到不了终点,同样对于抗体药物开发来说也很难实现最终的价值,也难以获得成功。
上面分析的以解决未满足的临床需求为目标的抗体药物研发策略属于战略层面的问题,那么如何实现这一目标,做出一些差异化的抗体药物就是战术层面的问题,分析FDA已经批准上市的70多个治疗性抗体药物以及目前处于临床后期研发阶段的几百个抗体药物,我们可以发现这些治疗性抗体药物的研发有两方面的重要变化:
(1)抗体药物的副作用可控,功能及疗效不断改进提升;
(2)单抗药物作用靶标不断扩大已拓展到新的疾病治疗领域和新的适应症。
治疗性抗体药物研发企业可以围绕上述两个方面开发一些能解决和满足实际临床需求的差异化产品,这两方面同样也是剖析抗体药物研发企业及相关产品价值的关键考量因素。
下面我们围绕这两方面并结合具体的实例来具体分析。
抗体药物质量控制贯穿于从抗体药物最初研发到病人使用的全过程,关于抗体全流程的质量控制的文章很多,本文就不再详细阐述。这里我们主要谈谈上面提到的抗体药物研发的两大方面的变化。
我们首先看看第一个方面:影响治疗性抗体药物副作用、功能及疗效的主要因素——治疗性抗体的免疫原性和效应功能,结合具体的实例分析一下。
1、通过削弱抗体药物的免疫原性以提升抗体药物的功能及疗效降低因免疫原性引起的副作用
我们可以通过四种方式降低抗体的免疫原性,消除人抗鼠(HAMA)反应:
(1)抗体人源化和开发人源抗体:可以通过移植鼠抗体的CDR到人抗体的相应部位和正确融合鼠抗体CDR 到人Ig 胚系框架中并建库用相应抗原筛库来实现; 截止2018年11月FDA批准的70多个治疗性抗体新药中全人源化单抗或人源化单抗药物已经成为主流,目前人源单抗的生产技术主要有转基因小鼠技术、抗体库技术、人工设计人源化抗体、EB病毒转化人B细胞、人-人杂交瘤细胞技术等,目前已经上市的全人源抗体中,大部分是通过转基因小鼠获得。
(2)通过分析设计去除抗体上能被人T 细胞识别的表位实现;
(3)通过引入Treg 表位并刺激Treg细胞功能,诱导对异源蛋白的耐受实现;
(4)通过糖基化修饰的改造来实现。
当然抗体药物的免疫原性还和其他一些因素有关,比如说给药途径,给药的频率,用药时间的长短以及病人自身免疫系统的状态,抗体药物生产过程中的问题,比如说杂质、聚体或其它污染物等。
因此抗体药物不光是在研发阶段,在抗体药物上市以后的使用过程中都需要严密的监测。对于抗体人源化的过程中需要我们充分考虑影响抗体稳定性及成药性的多种因素作出综合设计分析,从全局进行把控。在抗体药物研发进程中尽可能早的发现和去除影响抗体药物ADA的因素,尤其是抗体序列和结构上可能影响抗体药物ADA的因素,尽可能避免到抗体药物研发的较后期发现ADA而造成重大的损失
2、通过增强抗体的稳定性及效应功能以提升抗体药物的功能和疗效
目前FDA批准的抗体药物大都以IgG抗体为主,本节我们以传统的IgG抗体结构以及具体抗体药物的例子来分析增强抗体效应功能的策略。目前上市的以传统IgG结构为基础的治疗性抗体可以通过优化和改造Fab及Fc片段来增强抗体药物的稳定性及效应功能(图2)。
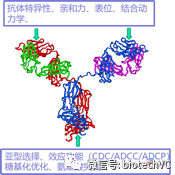
图2增强抗体药物效应的方法
2.1抗体Fab片段的优化
抗体Fab片段的CDR区参与了抗体与抗原的结合,通过与抗原结合发挥抗体的效应功能,抗体结合抗原以后可以阻断或中和靶分子的生物学功能,或与细胞膜表面分子结合引起细胞内信号通路的变化诱导细胞凋亡或抑制细胞增殖;通过结合靶标抗原调节人体的自身免疫系统或激活免疫细胞。
对抗体Fab片段CDR区域及框架区的优化可以提高抗体特异性、亲和力及结合动力学的特性进而增强抗体的稳定性及效应功能。下边我们看几个例子:
(1)通过优化奥马珠单抗(omalizumab)CDR残基提高抗体亲和力以增强体内效力
普特南等人研究了高亲和力抗IgE抗体-1(HAE1),该抗体是FDA批准的奥马珠单抗的高亲和力版本。HAE1与奥马珠单抗IgG1框架相同但CDR序列不同,其中9个CDR残基的变化使HAE1的koff降低约22倍,并且对IgE的结合亲和力提高约23倍。食蟹猴PK / PD研究中,HAE1只需要较低的浓度来抑制游离血清IgG水平,这表明HAE1的较高亲和力可能转化为更高的体内效力。
(2)优化帕利珠单抗增加kon来提高亲和力可以改善单抗IgG形式的病毒中和作用
帕利珠单抗(Palivizumab,商品名Synagis)是靶向呼吸道合胞病毒的人源化单抗,属于儿科领域的“重磅药”。帕利珠单抗可通过结合病毒表面上的RSV融合蛋白而阻断膜融合过程,也可以阻止被RSV感染的细胞间的融合过程,该抗体药物主要用于预防小儿呼吸道合胞病毒(RSV)感染。Wu等人应用定向进化方法来改善帕利珠单抗与RSV F蛋白的结合率(kon)和解离率(koff),并发现通过增加kon来提高亲和力可以改善单抗IgG形式的病毒中和作用,但是在提高抗体亲和力的同时需要同时充分考虑抗体的PK特性和组织的生物利用度。
那么抗体药物来说亲和力是不是越高越好呢?
对于抗体的亲和力我们需要辩证地去看,对于作用于不同靶标的抗体我们需要有区别的去分析判断,对于抗体药物来说其亲和力并不是越高越好,亲和力提高有可能提高抗体的疗效但同时也面临导致副作用增大的风险,当然抗体的亲和力降低,副作用可能会降低,但药效可能下降。
因此我们优化抗体亲和力的时候,需要兼顾到副作用和疗效,根据不同的作用靶点以及靶点在不同组织器官的表达情况确定抗体药物适合的亲和力,找到副作用及疗效的平衡点。
例如靶向EGFR 家族的抗肿瘤抗体药物可细分为靶向表皮生长因子受体EGFR的抗肿瘤抗体药物,靶向HER-2 的抗肿瘤抗体药物,靶向血管内皮生长因子VEGF/VEGFR 的抗肿瘤抗体药物。
其中以表皮生长因子受体EGFR为靶点的单抗药物已上市的有Cetuximab(西妥昔单抗)、panitumumab(帕尼单抗)和尼妥珠单抗(泰欣生,Nimotuzumab),它们用于治疗转移性结肠癌和头颈部肿瘤,通过阻断EGFR 信号通路发挥作用。
在Cetuximab(西妥昔单抗) 和panitumumab(帕尼单抗)治疗中,最常见的不良反应是皮肤反应(如过性痤疮样皮疹)和低镁血症(EGFR在肾髓袢中高表达),帕尼单抗的Kd为5×10-11(M),因此皮肤副作用相对较大,尼妥珠单抗(泰欣生,Nimotuzumab)的Kd约为2×10-8,皮肤的副作用较低。
靶向HER-2 的主要抗体药物为trastuzumab(曲妥珠单抗),通过阻断HER2 相关信号通路起作用,主要用于治疗乳腺癌和胃食道癌。此类药物常见副反应有心脏毒性、心力衰竭,有时有严重过敏反应,输液反应和肺中毒等,对于此类靶点的抗体亲和力同样不能太高,因此抗体亲和力的优化是需要我们在充分考虑成药性的前提下进行的。
好了,我们今天就讲到这,干货太长了好多小伙伴看不过来,下期我们接着讲糖基化改造。
如果对我们感兴趣,可以加微信:calmempty668 或 cfwf1010
以上文字由Biotech venture capital原创,仅为促进讨论与交流,不构成法律意见或咨询建议。版权所有,违者必究。如需转载,请注明作者和Biotech venture capital原创。
参考文献:
Leipold D, Prabhu S. Pharmacokinetic and pharmacodynamic considerations in the design of therapeutic antibodies.Clin Transl Sci. 2018 Nov 10.
Chan AC Carter PJ. Therapeutic antibodies for autoimmunity and inflammation.Nat Rev Immunol,2010,10( 5) : 301-316.
Weiner L M,Surana R,Wang S.Monoclonal antibodies:Versatile platforms for cancer immunotherapy.Nat Rev Immunol,2010,10( 5) : 317-327.
Kozlowski S, Swann P Current and future issues in the manufacturing and development of monoclonal antibodies.Adv Drug Deliv Rev,2006,58( 5-6) : 707-722.
图片部分来自网络,部分为作者亲自画的,尤其是下篇文章那个思维导图,我们独家IP,特公开分享给大家。
发布者:药时代,转载请首先联系contact@drugtimes.cn获得授权

 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
