正文共:3063字 15图
预计阅读时间:8分钟
眼科是一个庞大的市场,其中黄斑水肿市场超过200亿美金。黄斑水肿主要是由于血视网膜屏障功能破坏,使视网膜缺血,促使大量VEGF释放,促进血管新生进入黄斑区,导致液体渗漏在黄斑区积累,而导致黄斑水肿和视力受损。现在上市的药物主要是抑制血管新生,有Aflibercept、Ranibizumab、Faricimab。Aflibercept在2024年的年销售额已达到95.46亿美金。因此,多家公司均有布局眼科管线。
现有药物主要通过抑制VEGF-A通路抑制血管新生。据统计,大于45%的患者在接受VEGF–A阻断药物后未实现显著视力增加,25%的患者在一年后视力仍会继续恶化,仍存在未满足的临床需求。
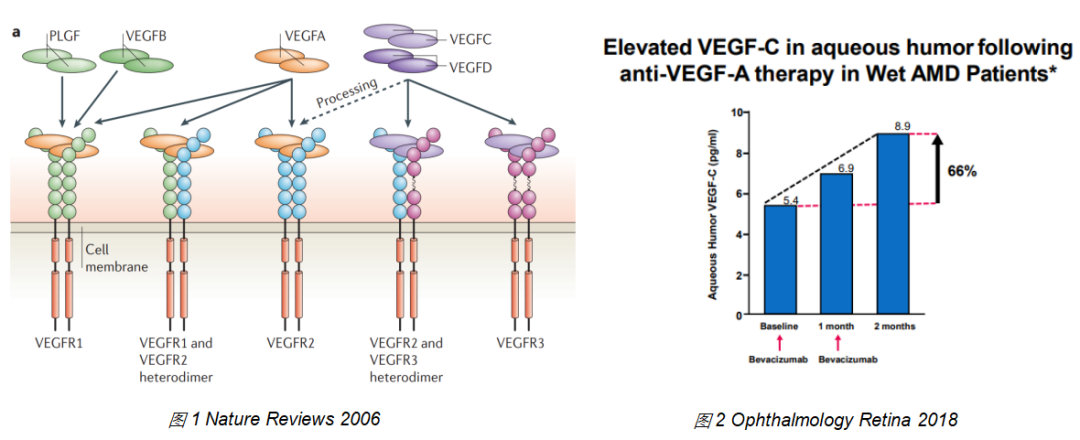
除了VEGF-A外,VEGF-C/D也可以激活VEGF通路(图1),促进血管新生。并且在wAMD患者接受VEGF阻断药物后,眼内VEGF-C会上升(图2)。提示机体可能通过增加VEGF-C代偿阻断VEGF-A的作用,从而降低VEGF-A阻断药物的药效。
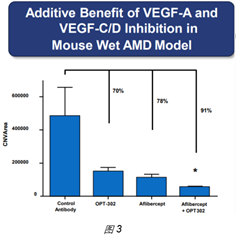
Opthea这家公司引进了一款anti–VEGF-C/D药物OPT-302。在小鼠激光照射眼睛诱导脉络膜血管新生模型中发现,OPT-302能够抑制血管新生,且能增强Aflibercept的药效(图3)。
该公司对这款药充满了信心,专注对OPT-302进行临床开发。我们来看看这家公司是怎样推进临床试验的。
黄斑水肿按诱因分为多种亚型,其中最大的市场是nAMD (Neovascular Age-related Macular Degeneration,新生血管型年龄相关性黄斑水肿),其次是DME (Diabetic macular edem,糖尿病性黄斑水肿)。Opthea将OPT-302定位于现有VEGF阻断药物的后续治疗,并且需要与现有VEGF阻断药物联用。图4展示了公司的临床试验计划和进展。
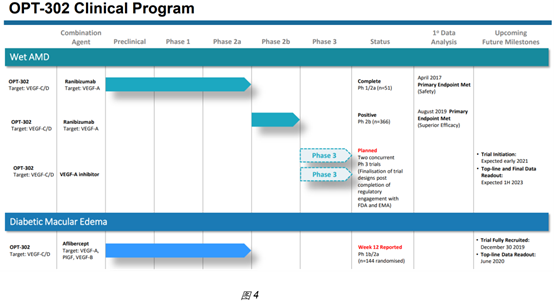
在开展3期前,在DME中选择的VEGF阻断药物经治病人,未见对Aflibercept的增效;在nAMD中选择的未使用过VEGF阻断药物的病人,其1期结果未见披露,仅披露了2期结果。在nAMD中的2期试验是非常大的2期试验,招募了962人,入组了366人;虽然在第24周2mg OPT-302与Ranibizumab联用后,较Ranibizumab有显著药效(图5),但可见药效差异并不到。Opthea对nAMD亚型进行了细分,发现在Occult lesion type和PCV lesion type亚型中有更显著地提升。
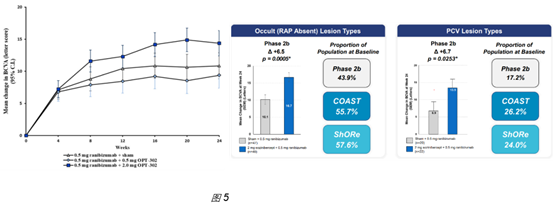
基于此,其开展了2个3期试验,一个选择了2期试验所用的对标药物Ranibizumab,另一个选择了Aflibercept;并且在这2个3期试验中均同时测试OPT-302两个给药频率。招募规模与2期相似,均是九百多人,并且在招募中提高了上述有更显著药效的nAMD亚型病人。
可惜公司2025年3月披露,两项3期试验在整个人群,以及在任何亚群中,均未看到显著药效。
OPT-302的失败并非偶然,三点促成了其失败:
1. 忽略了OPT-302的2大自身短板,未积极开发和推进二代药物
短板1:机制上只能与VEGF-A阻断药物联用。因为VEGF-A在血管新生中占主导作用,单独阻断VEGF-C/D药效肯定弱于现在上市的靶向VEGF-A的药物。
短板2:成药性差。针对的适应症需要在眼睛玻璃体内注射,注射体积有限,一般给药体积是50-70ul。注射体积太大会引起眼内压升高风险,因此,药物比拼的是最小体积能达到多少mg。同时可以达到的浓度越大,越有可能提高给药周期。因为病人不愿意进行频繁的眼内注射,所以现在上市药物不断在探索增加单次给药量来降低给药频率。Aflibercept已经能做到8 mg/70ul,由原来的Q4W,可以实现Q16W。OPT-302只能做到2 mg/50ul。因此,联用用药就是50ul + 50ul,很容易引起眼内压升高,且延长给药周期的潜力较小。
未积极布局二代药物。公司未披露与αVEGF-A组合双抗的开发情况,但官网显示有布局OPT-302与VEGF-A药物co-formulation制剂,只是还在评估可行性。反观信达生物,其开发了VEGF-A Trap x VEGF-C双抗,机制上能保证药效。
2. 临床试验太过激进
定位过高。最开始直接定位于prior-treated的患者。在临床2期测试时,才专注treatment naïve患者,且直接在nAMD中测试。一般策略是先在treatment naïve DME(这群病人对VEGF阻断药物响应更好)中确定临床药效后,再逐步放大。
临床试验太多。由于是测试OPT-302与Aflibercept或Ranibizumab联用后的增效能力,对比组和对照组均需要Aflibercept或Ranibizumab,试验成本很高。公司却仍然选择在wAMD和DME两个适应症中测试,并开展2项3期试验,2项试验中均测试了OPT-302的两个给药周期(Q4W和Q8W)。
3. 对临床数据盲目自信
2期试验中,DME适应症选择的prior-treated DME患者,在整个人群(n = ~108)中,没看到OPT-302对Aflibercept的增效;nAMD适应症选择的treatment naïve nAMD患者,实际招募了962人,入组了366人,每个测试组大概120人。在这么大型的nAMD 2期临床试验中,在低剂量组(0.5mg)没有看到药效;在最高剂量组(2mg)看到了显著差异(p=0.01 at week 24, 图5),但这个差异并不大。并且这个2期试验是在10个国家、109个中心开展的。对这样混杂的大型的临床数据的解读是不是应该更保守点?
3期试验是在33个国家、~400个中心开展的。从2021年3月开始招募,2023年公司披露该试验已完成~75%的入组,但公司迟迟未公布topline data,直到今年3月才披露开展的2项3期失败的结果。
公司应该默默承担着不少压力,因为其临床试验过于激进,导致其虽然在2020年已经纳斯达克上市,但仍需获得额外融资。由于对临床数据的盲目自信,在2022年其选择进行非股权稀释性融资。如今临床失败,可能面临巨额还款。

靠一款药撑起一家公司已有很多成功案例,但是能否赌对一款药,还是要综合分析现有治疗药物的最大短板、突破性药物的作用机制和目标市场。在这个万物皆可联的时代,比拼的还是对疾病发病机制、靶点和药物作用机制的理解,当然还有从成药性角度优化分子的能力。
参考资料:
1. 公司官网
2. 药时代BD需求 | 寻找眼科创新药项目,考虑小分子、单抗/多抗、核酸药物、分子胶、基因疗法……
3. 其它公开资料
版权声明/免责声明
本文为原创文章。
本文仅作信息交流之目的,不提供任何商用、医用、投资用建议。
文中图片、视频、字体、音乐等素材或为药时代购买的授权正版作品,或来自微信公共图片库,或取自公司官网/网络,部分素材根据CC0协议使用,版权归拥有者,药时代尽力注明来源。
如有任何问题,请与我们联系。
衷心感谢!
药时代官方网站:www.drugtimes.cn
联系方式:
电话:13651980212
微信:27674131
邮箱:contact@drugtimes.cn
本篇文章来源于微信公众号: 药时代
发布者:haitao.zhao,转载请首先联系contact@drugtimes.cn获得授权

 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 





