
一
Craig Crews 一直致力于蛋白降解剂的研究,尤其是靶向蛋白降解嵌合体(PROTACs)的研究。与抑制剂只能抑制蛋白的活性不同,PROTACs 可直接诱导蛋白降解,且 PROTACs 不需要和靶蛋白有高度的亲和力,这极大的缩小了不可成药靶标的范围,而且也不会存在抑制剂导致靶蛋白在细胞内的大量积累的情况。如今靶向蛋白降解模式的存在似乎是理所应当,可这条路,Crews走了20年,他为什么坚信靶向蛋白降解的未来,又是怎么克服其中困难,把一个冷门带向了当前的热点。请观看 Crews 汇报的“ PROTACs: The Past, Present and Future of Targeted Protein Degradation”。
二
Craig Crews 是靶向蛋白质降解领域的先驱,在弗吉尼亚大学获得化学学士学位,在哈佛大学获得生物化学博士学位,目前是耶鲁大学分子、细胞和发育生物学、化学和药理学教授。在耶鲁大学的25年里,Crews的实验室率先使用小分子来控制细胞内蛋白质水平,导致了多家成功的生物技术公司的成立。他本人也于2013年创立了Arvinas,目前进展较快的 ARV110、ARV766 和 ARV471 已成功推向推向临床研究,其中 ARV110 和 ARV471 已经进入临床二期。

三
第一阶段:概念的提出和证明
1. 靶向蛋白降解概念的提出
2001年,crews 和 Raymond首次提出PROTAC概念,为了验证概念的可行性,他们将甲硫氨酰氨肽酶-2(MetAP-2)的共价抑制剂ovalicin和能识别Skp1-Cullin- F-box (SCF) 泛素连接酶的磷酸肽偶联,合成了第一个靶向蛋白降解的嵌合分子PROTAC 1,该分子可将 MetAP-2 招募至SCF,诱导其泛素化和降解。值得注意的是初代PROTAC是直接在非洲爪蟾蛙卵提取物中进行试验的[1]。

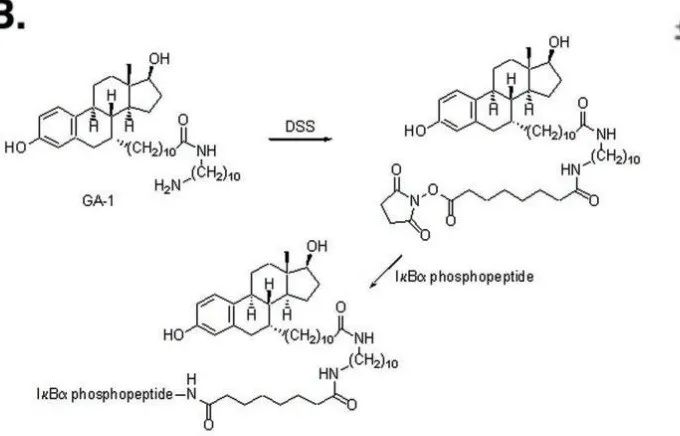

2004年,Crews课题组设计了招募 VHL 靶向 FKBP 的 肽基 PROTAC,并在多肽的末端引入能够加速细胞转运的聚D-精氨酸,以提高PROTAC的膜穿透性和抵抗非特异性蛋白水解的能力,实验发现 25 µM PROTAC 处理细胞 2.5 h,就可以观察到细胞中明显的EGFP- FKBP 降解[3]。

第二阶段:全小分子 PROTAC 时代

2. PROTAC一系列概念的提出

同年,Crews又分别发表了基于 CRBN 和 VHL 的 PROTAC,使 PROTAC 进入了一个全新的发展阶段,并衍生出一系列概念,如半数最大降解浓度 DC50、最大降解率 DCmax、HOOK效应和连接学(Linkerology)等等一系列概念。
由此 PROTAC 开始进入合理化设计阶段,即设计之初就要通盘考虑靶蛋白的配体、E3连接酶的种类以及Linker等等一系列概念。如 PROTAC 和靶蛋白的二元亲和力和降解效率并没有直接关系,Linker 的长度、种类对降解效果影响巨大,招募不同的E3连接酶也可能会有完全不同的降解效果。
四
2003年,Craig Crews 联合创立 Proteolix, Inc.,其蛋白酶体抑制剂Kyprolis™已经获得FDA批准,用于治疗多发性骨髓瘤。
2013 年,Craig Crews 创立 Arvinas,同年九月完成1500万美元融资,后分别于2015年和2018 年完成B轮和C轮共 9660 万美元融资。2018年10月1日,Arvinas在纳斯达克上市,完成1.7亿美元融资。2019年3月,Arvinas宣布治疗前列腺癌的PROTAC分子 ARV-110 进入一期临床实验。5月,ARV-110 获FDA批准进入审批快速通道。同年9月,治疗局部晚期或转移性ER+/HER2-乳腺癌的PROTAC分子 ARV-471的临床申报申请获得FDA批准。2020年5月,在ASCO会议上,Arvinas 公布 ARV-110 的全部临床一期数据,总体来看,Arvinas 具有良好的安全性和有效性,首次证明了PROTAC在人体内可成功降解靶蛋白,对前列腺癌有效。2021年4月,在美国癌症研究协会年会,公布了ARV-110和ARV-471的分子结构。

https://www.arvinas.com/
2. Sakamoto, K. M. et al. Development of Protacs to target cancer-promoting proteins for ubiquitination and degradation. Mol. Cell. Proteomics 2, 1350–1358 (2003).
3. Schneekloth, J. S. et al. Chemical Genetic Control of Protein Levels: Selective in Vivo Targeted Degradation. J. Am. Chem. Soc. 126, 3748–3754 (2004).
4. Targeting steroid hormone receptors for ubiquitination and degradation in breast and prostate cancer. 2008 (2008).
5. Schneekloth, A. R., Pucheault, M., Tae, H. S. & Crews, C. M. Targeted intracellular protein degradation induced by a small molecule: En route to chemical proteomics. Bioorganic Med. Chem. Lett. 18, 5904–5908 (2008).
6. Buckley, D. L. et al. HaloPROTACS: Use of Small Molecule PROTACs to Induce Degradation of HaloTag Fusion Proteins. ACS Chem. Biol. 10, 1831–1837 (2015).

http://www.prodedrug.com
成都分迪药业有限公司是一家致力于为癌症和病毒性感染等难以治疗的疾病开发免疫新疗法药物的新药研发公司。我们专有的PRODED™ 免疫新疗法小分子药物(分子胶水——Molecular Glue)利用泛素-蛋白酶体途径诱导致病靶蛋白的降解,并激活免疫,以期治愈癌症和病毒感染性疾病。在传统蛋白降解剂的基础上,分迪药业开创性地将蛋白降解和免疫自调机制相结合,并率先将人工智能(AI)、分子模拟和药物设计等技术应用于免疫新疗法的小分子新药开发中,以加速高成药性的先导化合物的发现,快速推进免疫新疗法的“分子胶水”新药上市。

本文为授权转载,仅供感兴趣的个人谨慎参考,非商用,非医用、非投资用。
欢迎朋友们批评指正!衷心感谢!
文中图片为授权正版图片,或来自微信公共图片库,或取自网络
根据CC0协议使用,版权归拥有者。
任何问题,请与我们联系。衷心感谢!

推荐阅读








 点击这里,欣赏更多精彩内容!
点击这里,欣赏更多精彩内容!本篇文章来源于微信公众号:药时代
发布者:药时代,转载请首先联系contact@drugtimes.cn获得授权

 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 